测定植物铁含量的比色法
Summary
我们提出了一个简单可靠的协议, 以测量植物组织中的铁含量使用比色普鲁士蓝法。
Abstract
铁是生物体中最重要的微量营养素之一, 涉及呼吸和光合作用等基本过程。在所有生物体中, 铁含量相当低, 相当于植物的约0.009% 的干重。迄今为止, 测定植物组织中铁浓度的最准确方法之一是火焰吸收原子吸收光谱法。然而, 这种方法耗时且昂贵, 需要在工厂实验室中不常见的特定设备。因此, 需要一个简单而准确的方法, 可以经常使用。在动物和植物组织学切片中, 经常使用比色普鲁士蓝法进行定性铁染色。本研究采用普鲁士蓝法对烟叶中铁进行定量测定。我们验证了这种方法的准确性, 利用原子吸收光谱和普鲁士蓝染色测量相同样品中的铁含量, 并发现两个程序之间的线性回归 (R2 = 0.988)。我们的结论是, 普鲁士蓝法的定量铁测量在植物组织是准确的, 简单的, 廉价的。然而, 在这里提出的线性回归可能不适合其他植物物种, 由于潜在的相互作用的样品和试剂。因此, 需要为不同的植物物种建立一个回归曲线。
Introduction
铁 (Fe) 是所有生物中重要的微量营养素。在植物中, 它是一种必需的微量营养素1 , 因为它参与了基本的过程, 如呼吸, 光合作用和叶绿素生物合成。由于反应导致释放自由基导致氧化应激, 游离铁离子的高积累对植物细胞有害。为了维持植物细胞内的铁稳态, 离子储存在 ferritins 内, 直接参与铁稳态2的蛋白质笼和所有生物体中铁的主要贮存结构。同时, 缺铁性贫血会影响到人口的很大比例, 从而增加了对植物铁生物强化的需求。由于植物铁蛋白的独特特性, 用铁蛋白进行食品浓缩, 为解决营养不良3的问题提供了一个有前景的战略。
铁离子主要见于两种氧化状态, 即黑色金属 (价 fe2 +或铁 (II)) 和铁 (三价 fe3 +或铁 (III)) 的形式。在细胞中也发现了其他几种形式的铁, 如铁簇4。Fe 在细胞之内被存放作为氧化铁并且自然地形成 hematites (fe2O3) 和 ferryhidrites (fe3 +)2O3· 0.5H2o) 在生理情况下5。在这些反应中形成的氢氧化物, 特别是铁形态, 具有很低的溶解度。铁的保留因此受到溶液 ph 值的影响, 并且在很大程度上是在 ph 值 56以上的固态状态。
考虑到铁的溶解度低、反应性高, 其在植物组织和器官中的转移必须与合适的螯合分子相联系。此外, 它的氧化还原状态之间的铁和铁形式1必须控制。在叶内, 约80% 的铁是在光合细胞中发现的, 由于其在电子运输系统中的重要作用, 在生物合成细胞色素, 叶绿素和其他血红素分子, 以及在形成铁 S 簇7。在细胞内铁过量的情况下, 剩余移位进入液泡中, 金属在铁蛋白分子中储存8。
在植物组织中, 铁可以用几种方法来测量, 包括火焰原子吸收光谱9 (原子吸收光谱法) 或比色测定10, 前者比后者精确得多。火焰原子吸收光谱法是一种高度精确的技术, 使人们能够根据单个元素的电磁辐射来确定样品的元素组成。火焰原子吸收光谱法将金属离子转化为原子态, 通过样品的加热, 导致离子激发和特定波长的发射, 当给定离子返回其基态时。不同离子的排放由单色仪分离, 并通过吸收传感器11进行检测。火焰原子吸收光谱因而服务直接地定量铁浓度。然而, 在生物组织中可视化铁的其他技术是可用的。电感耦合等离子体质谱 (ICP)12是一种非常精确的测量铁和其他微量元素的技术, 但对于火焰原子吸收光谱和 ICP-ms 的设备缺乏是一个普遍的问题。另一方面, 硫氰酸盐比色法测定铁量13缺乏精度, 无法检测样品之间的细微变化。普鲁士蓝染色14、15、16、17是基于铁离子盐 (K4Fe (CN)6) 反应的间接方法, 产生了强蓝色, 用于动物和植物组织组织学切片中的定性铁检测。
金属 (零价) 铁在岩石圈中是罕见的。环境中铁的主要非复合离子形式主要由环境中的氧量决定, 铁在缺氧环境中相对丰富, 铁在有氧场所占主导地位。后一种形态在极酸性环境中也占主导地位, 但在缺氧和酸性环境下, 铁氧化的致病剂往往不同于18。当铁在 4% HCl (pH 0) 在一个有氧环境中可溶性时, 稀释铁的主要部分存在作为铁形式 (Fe3 +)19,20。
铁离子与 K4Fe (CN)6的反应如下:
Fe3 +: FeCl3 + K4Fe (cn)6 = KFe (III) Fe (cn)6¯ + 3KCl
Fe2 +: 4 FeCl2 + 2 K4Fe (cn) 6 = fe4(Fe (CN)6)2 + 8 氯化钾
在本研究中, 我们询问普鲁士蓝染色是否有助于测定溶液中的铁含量。
初步验证了水溶液中铁浓度与普鲁士蓝染色的相关性。Fe (作为 FeCl2, FeCl3或1:1 混合物的二) 集中在水溶液由原子吸收光谱和吸收 (OD) 在普鲁士人的蓝色的加法以后测量。图 1显示了每个方法获得的测量的线性回归曲线。结果表明, 普鲁士蓝法可用于定量分析溶液中铁的浓度。
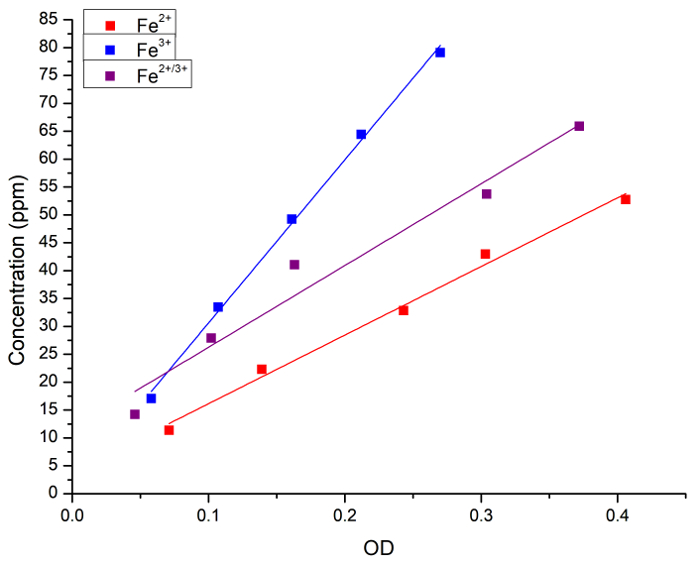
图 1: 用火焰原子吸收光谱法测定的铁浓度与由普鲁士蓝方法获得的光吸收 (OD, 715 nm) 之间的线性回归.蓝色正方形和线代表 fe2 +解答, 红色正方形和线代表 fe3 +解答, 并且黑正方形和线代表1:1 混合物在 fe2 +和 fe3 +之间。得到了以下回归: [Fe2 +] = 3 + 123 x OD, r = 0.996, r2 = 0.989;[Fe3 +] = 1 + 292 x OD, r = 0.999, r2 = 0.997;和 [Fe2 +/3 +] = 11 + 146 x OD, r = 0.983, r2 = 0.956。fe2 +捐赠者是 FeCl2和 fe3 +捐赠者是 FeCl3。请单击此处查看此图的较大版本.
为了适应比色普鲁士蓝法对植物组织进行定量分析, 用火焰原子吸收光谱和普鲁士蓝染色测定烟叶灰分的铁含量。这两种技术的结果有很好的相关性。
Protocol
Representative Results
Discussion
植物组织中铁的测量对于评价灌溉或其他环境条件的影响非常重要。在这里, 我们描述了一个简单和准确的比色法测定烟叶中的铁含量, 可以很容易地适应其他植物种类和组织。
在优化比色法的条件下, 我们用低 ph 介质 (ph < 1.0) 来允许铁的溶解度。燃烧过程的执行, 以释放所有形式的铁, 并确保不存在的污染物在样品将修改结果。关于铁污染, 人们应该记住, 6.7% 的地壳包括氧化…
Divulgations
The authors have nothing to disclose.
Acknowledgements
这项工作得到了以色列农业部首席科学家 (#16-16-0003) 的赠款的支持, 得到了以色列国科学、技术和 Spaceand。
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

