Demir içeriği tesislerinde ölçme kolorimetrik yöntemi
Summary
Biz demir içeriği bitki dokularında Renkölçer Prusya Mavisi yöntemini kullanarak ölçmek için basit ve güvenilir bir iletişim kuralı mevcut.
Abstract
Demir, yaşayan organizmalar, en önemli mikro basic süreçler, solunum ve fotosentez gibi ilgilenmektedir. Demir içeriği tesislerinde kuru ağırlığının yaklaşık % 0,009 tutarında tüm organizmalarda oldukça düşüktür. Bugüne kadar bitki dokularında demir konsantrasyonu ölçmek için en doğru yöntem alev emme atomik Spektroskopi biridir. Bununla birlikte, bu yaklaşım pahalı ve zaman alıcı ve özel ekipman değil sık bitki laboratuvarlarında bulunan gerekir. Bu nedenle, rutin olarak kullanılan basit, henüz doğru yöntemi gereklidir. Renkölçer Prusya Mavisi yöntemi düzenli olarak nitel demir hayvan ve bitki histolojik bölümlerde boyama için kullanılır. Bu çalışmada, Prusya Mavisi yöntemi için nicel ölçümler demir tütün yaprakları uyarlanmış. Biz bu yöntemi kullanarak atomik Spektroskopi ve Prusya Mavisi demir içeriği aynı örnekte ölçmek ve bir doğrusal regresyon bulundu boyama doğruluğunu doğrulanmış (R2 0.988 =) iki prosedür arasındaki. Prusya Mavisi yöntemi kantitatif demir ölçüm bitki dokularında için kesin, basit ve ucuz olduğu sonucuna varıldı. Ancak, burada sunulan doğrusal regresyon örnek ve reaktif arasındaki potansiyel etkileşimler nedeniyle diğer bitki türleri için uygun olmayabilir. Bir regresyon eğrisi kurulması böylece farklı bitki türü için gereklidir.
Introduction
Demir (Fe) tüm canlılar içinde önemli bir mikro besin olduğunu. Bitkiler, solunum, fotosentez ve klorofil sentezi gibi temel süreçleri onun katılımı nedeniyle bir önemli mikro besin1 biridir. Özgür demir iyonları yüksek birikimi hücreleri serbest radikallerin oksidatif strese neden serbest bırakmak önde gelen tepkiler nedeniyle bitki için zararlıdır. Bitki hücre içinde demir homeostazı korumak için iyonlar boşluklar içinde saklanır ve ferritins, protein kafes demir homeostazı2 ‘ doğrudan ilgili ve demir tüm canlılar içinde asıl depolama yapısı içinde münzevi. Aynı zamanda, demir eksikliği anemisi bitki Fe biofortification için artan bir ihtiyaç sonuçlanan insan nüfusunun önemli bir bölümünü etkiler. Bitki ferritin benzersiz özellikleri nedeniyle, bu sorun yetersiz beslenme3savaşmak için bir umut verici strateji Gıda Zenginleştirme ferritin-demir ile sunmaktadır.
Demir iyonları esas olarak bulunan iki oksidasyon durumu vardır, yani demir çelik (divalent Fe2 + veya demir (II)) ve demir (değerlikli Fe3 + veya demir (III)) formları. Demir, demir kümeleri4gibi çeşitli diğer formları da hücrelerde bulunur. Fe demir oksit hücre ve doğal olarak formlar hematites (Fe2O3) ve içinde ferryhidrites olarak depolanır ((Fe3 +)2O3•0.5 H2O) fizyolojik şartlarda5altında. Bu tepkiler, özellikle ferrik formu, kurulan ve hidroksitler çok düşük çözünürlük var. Demir tutma sonuç olarak çözüm pH tarafından etkilenir ve büyük ölçüde bir katı pH 56yukarıdaki durumda.
Yoksul çözünürlük ve yüksek reaktivite Fe göz önüne alındığında, onun transfer bitki doku ve organları arasında uygun şelat molekülleri ile ilişkilendirilmiş olması gerekir. Ayrıca, onun redoks durumlar arasında demir çelik ve demir formlar1 kontrol altına alınmalı. Yaprakları içinde demir yaklaşık % 80’i içinde biyosentezi cytochromes, klorofil ve diğer heme moleküller elektron taşıma sistemi önemli rolleri nedeniyle fotosentetik hücrelerde bulunur ve Fe-S oluşumunda7kümeleri. Hücre içinde aşırı demir söz konusu olduğunda, metal ferritin molekülleri8‘ depolandığı çarpıtması içine fazla translocated.
Demir bitki dokularda çeşitli yöntemler, dahil alev Atomik Absorpsiyon spektroskopisi9 (FAAS) veya Renkölçer deneyleri10, ikincisi çok daha hassas olmak eski tarafından ölçülebilir. FAAS tek tek öğeleri elektromanyetik emisyon temelinde bir örnek elemental kompozisyonu belirlemek sağlar son derece hassas bir tekniktir. FAAS metal iyonları atomik Amerika’ya örnek, alev ısı tarafından verilen bir iyon zemin durumuna geri döndüğünde iyon uyarma ve belirli bir dalga boyu emisyon yol dönüştürür. Farklı iyonları emisyonları monokromatör tarafından ayrılmış ve bir emme sensör11tarafından algılandı. FAAS böylece doğrudan demir konsantrasyonları ölçmek için hizmet vermektedir. Ancak, biyolojik dokularında demir görüntülenmesi için diğer teknikleri kullanılabilir. İndüktif Eşleşmiş Plazma kütle spektroskopisi (ICP-MS)12 demir ve diğer eser elementler ölçmek için çok hassas bir tekniktir ancak ekipman, FAAS ve ICP-MS, için hem de eksikliği sık karşılaşılan bir sorundur. Öte yandan, demir ölçüm thiocyanate colorimetry13 tarafından hassas yoksun ve örnekleri arasında küçük farklılıklar algılamak başarısız olur. Prusya14,15,16,boyama17 potasyum demir ferrocyanide (K4Fe(CN)6) Fe katyonlar, üreten ile reaksiyon dayalı bir dolaylı Yöntem mavidir bir güçlü mavi renk ve hayvan ve bitki dokusu histolojik bölümlerini nitel demir algılama için kullanılır.
Metalik (sıfır-valent) demir Yerkabuğu içinde nadirdir. Demir ortamında hakim complexed iyonik formu çoğunlukla demir demir nispeten daha anoksik ortamlarda bol olmak ve aerobik Siteler’de predominating ferrik demir ile çevresinde, oksijen miktarına göre belirlenir. Demir demir oksidasyonu sorumlu ajanlar kez anoksik ve asidik ortamda18farklı olsa da bu ikinci formu aynı zamanda son derece asidik ortamlarda, hakimdir. Ne zaman demir %4 oranında çözündürüldükten bir aerobik ortamda (pH 0) HCl, seyreltilmiş demir büyük bir kısmını var demir (Fe3 +)19,20biçimi olarak.
Fe iyonları ile K4Fe(CN)6 arasında reaksiyonlar aşağıdaki gibidir:
Fe3 +: FeCl3 + K4Fe(CN)6 KFe(III)Fe(II)(CN)6¯ + 3KCl =
Fe2 +: 4 FeCl2 + 2 K4Fe(CN)6 Fe4(Fe(CN)6)2 + 8 = KCl
Bu da çalışmanın, Prusya mavi boyama çözüm demir düzeyleri ölçmek için yararlı olabilir olup olmadığını sordu.
Başlangıçta, sulu çözüm Fe’de konsantrasyon ve Prusya mavi boyama arasındaki korelasyon doğrulanmadı. Fe (olarak FeCl2, FeCl3 veya ikisinin bir 1:1 karışımı) konsantrasyon sulu çözümler hem atomik Spektroskopi ve absorbans (OD) tarafından Prusya Mavisi eklenmesinden sonra ölçüldü. Şekil 1 her yöntemi ile elde edilen ölçümler için doğrusal regresyon eğrileri gösterir. Prusya mavi Yöntem Nicel analiz çözümde demir konsantrasyonunun kullanılabilir sonucuna vardı.
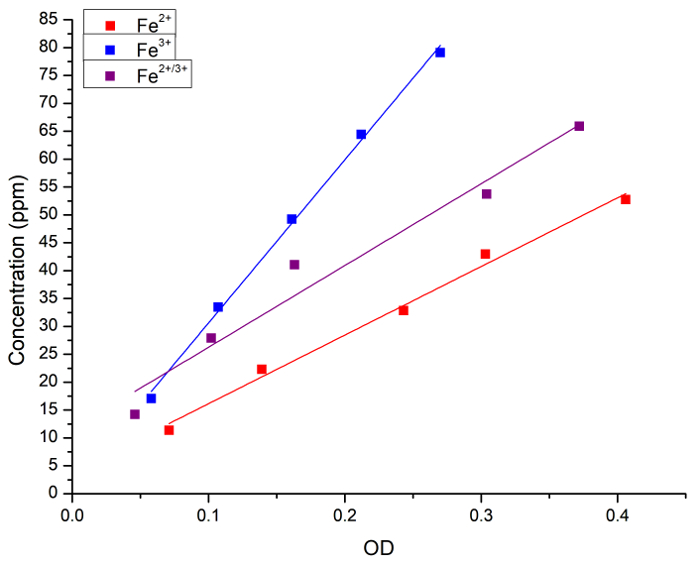
Şekil 1: Fe konsantrasyonu arasında doğrusal regresyon ölçülen FAAS ve ışık absorbans tarafından (OD, 715 nm) Prusya mavi yöntemiyle elde edilen. Mavi kareler ve çizgi Fe2 + çözüm temsil, Fe3 + çözüm ve siyah kareler kırmızı kareler ve çizgi temsil ve satır temsil Fe2 + ve Fe3 +arasında 1:1 karışımı. Aşağıdaki regresyon elde edilmiştir: [Fe2 +] 3 + 123 x OD = r = 0.996, R2 = 0.989; [Fe3 +] 1 + 292 x OD = r 0.999, R2 = 0.997; = ve [Fe2 + / 3 +] 11 + 146 x OD = r 0.983, R2 = 0.956 =. Fe2 + donör FeCl2 ve Fe3 + donör FeCl3oldu. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Renkölçer Prusya mavi yöntemi kantitatif demir bitki doku analizi için uyarlamak için tütün yaprağı külleri demir içeriği alev emme atomik Spektroskopi ve Prusya mavi boyama tarafından ölçüldü. İyi korelasyon sonuçlarından tarafından iki teknik arasında yapıldı.
Protocol
Representative Results
Discussion
Bitki dokularında demir ölçüm sulama veya diğer çevresel koşullar etkilerini değerlendirmek için çok önemlidir. Burada, diğer bitki türleri ve dokuları ile kolayca adapte edilebilir tütün yaprakları Fe içerik ölçüm için bir kolay ve doğru kolorimetrik yöntemi açıklanmıştır.
Koşullar kolorimetrik yöntemi için optimize, biz düşük pH Orta (pH < 1.0) demir çözünürlük sağlamak için kullanılır. Yanma süreci demir her türlü serbest bırakmak için ve hi?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu eser İsrail Bakanlığı Bilim, teknoloji ve uzay tarafından Tarım (#16-16-0003) İsrail Bakanlığı baş bilim bir hibe tarafından desteklenmiştir.
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

