Een colorimetrische methode voor het meten van ijzergehalte in planten
Summary
Wij presenteren een eenvoudige en betrouwbare protocol voor het meten van ijzergehalte in plantaardige weefsels met behulp van de colorimetrische Pruisisch blauw-methode.
Abstract
Ijzer, één van de meest belangrijke micronutriënten in levende organismen, is betrokken bij basic processen, zoals ademhaling en fotosynthese. Ijzergehalte is vrij laag in alle organismen, ten bedrage van in planten ongeveer 0.009% van het drooggewicht. Tot op heden, is een van de meest nauwkeurige methoden voor het meten van de concentratie van het ijzer in plantaardige weefsels vlam atomaire absorptie spectroscopie. Echter, deze aanpak is tijdrovend en duur en vereist specifieke apparatuur niet vaak gevonden in de laboratoria van de plant. Dus is een eenvoudiger, maar nauwkeurige methode die kan worden routinematig gebruikt nodig. De colorimetrische Pruisisch blauw-methode wordt regelmatig gebruikt voor kwalitatieve ijzer kleuring in dier- en plantensoorten histologische secties. In deze studie aangepast we de Pruisisch blauw methode voor kwantitatieve metingen van ijzer in tabak verlaat. Wij gevalideerde de nauwkeurigheid van deze methode met behulp van zowel atomaire spectroscopie en Pruisisch blauw kleuring gevonden van een lineaire regressie te meten ijzergehalte in de dezelfde monsters (R2 = 0.988) tussen de twee procedures. We concluderen dat de Pruisisch blauw-methode voor meting van de kwantitatieve ijzer in plantaardige weefsels nauwkeurige, eenvoudige en goedkope. De lineaire regressie hier gepresenteerd kan echter niet dienstig voor andere plantensoorten, als gevolg van mogelijke interacties tussen het monster en reagens. Oprichting van een regressie-curve is dus nodig voor verschillende plantensoorten.
Introduction
Ijzer (Fe) is een belangrijke micronutriënt in alle levende organismen. In planten is het een essentiële micronutriënt1 vanwege zijn betrokkenheid bij fundamentele processen, zoals ademhaling, fotosynthese en chlorofyl biosynthese. Hoge accumulatie van vrij ijzer ionen is schadelijk voor de plantaardige cellen als gevolg van reacties leidt tot het vrijkomen van vrije radicalen veroorzaakt oxidatieve stress. U behoudt ijzer homeostase binnen de plant cel, zijn ionen opgeslagen in de vacuolen en afgezonderd binnen ferritins, eiwit kooien rechtstreeks betrokken is bij iron homeostase2 en de opslagstructuur van de belangrijkste van ijzer in alle levende organismen. Ijzertekort bloedarmoede beïnvloedt tegelijkertijd, een aanzienlijk deel van de menselijke bevolking, wat resulteert in een toenemende behoefte aan plant Fe biofortification. Als gevolg van de unieke eigenschappen van de plant Ferritine biedt voedsel verrijking met Ferritine-strijkijzer een veelbelovende strategie ter bestrijding van dit probleem van ondervoeding3.
Ijzer ionen zijn voornamelijk gevonden in twee oxidatie Staten, namelijk de Ferro (divalente Fe2 + of ijzer (II)) en ijzer(III) (driewaardig Fe3 + of ijzer (III)) vormen. Verschillende andere vormen van ijzer, zoals ijzer clusters4, zijn ook gevonden in de cellen. Fe wordt opgeslagen als ijzeroxide binnen de cel en natuurlijk vormen hematites (Fe2O3) en ferryhidrites ((Fe3 +)2O3•0.5 H2O) onder fysiologische omstandigheden5. De hydroxiden gevormd bij deze reacties wordt vooral de ijzer(III) vorm, hebben zeer lage oplosbaarheid. IJzeren retentie wordt dus beïnvloed door de pH van de oplossing en is grotendeels in een vaste toestand boven pH 5-6.
Gezien de slechte oplosbaarheid en hoge reactiviteit van Fe, moet haar overdracht tussen plantaardige weefsels en organen gepaard gaan met geschikte chelaatvormers moleculen. Bovendien moeten haar redox-Staten tussen de ferro- en ijzer(III) vormen1 worden gecontroleerd. Binnen bladeren, ongeveer 80% van het ijzer is gevonden in de fotosynthetische cellen, vanwege haar essentiële rol in het elektronentransport systeem, in de biosynthese van de cytochromes, chlorofyl en andere Heem moleculen, en bij de vorming van Fe-S clusters7. In het geval van ijzer overtollige binnen de cel, wordt het overschot in de vacuole waar het metaal wordt opgeslagen in de Ferritine moleculen8translocated.
Ijzer kan worden gemeten in plantaardige weefsels door verschillende methoden, inclusief vlam atomaire absorptie spectroscopie9 (FAAS) of colorimetrische testen10, de voormalige wordt veel nauwkeuriger dan de laatste. FAAS is een zeer nauwkeurige techniek waarmee een te bepalen van de elementaire samenstelling van een monster op grond van de elektromagnetische emissie van de afzonderlijke elementen. FAAS omgezet in metaalionen atomaire Staten door vlam-verwarming van het monster, wat leidt tot ion excitatie en emissie van een specifieke golflengte wanneer een bepaalde ion naar de grondtoestand terugkeert. De emissies van de verschillende ionen zijn gescheiden door een monochromator en gedetecteerd door een absorptie sensor11. FAAS dient dus te kwantificeren direct concentraties ijzer. Andere technieken voor het visualiseren van ijzer in biologische weefsels zijn echter beschikbaar. Inductief gekoppeld plasma-mass spectroscopie (ICP-MS)12 is een zeer exacte techniek voor het meten van ijzer en andere sporenelementen, maar het gebrek aan apparatuur, zowel voor FAAS en ICP-MS, is een veelvoorkomend probleem. Aan de andere kant, meting van de ijzer door kaliumthiocyanaat colorimetrie13 ontbreekt precisie en kleine verschillen tussen monsters herkent. Pruisisch blauw kleuring van14,15,16,17 is een indirecte methode op basis van de reactie van ijzer(III) kaliumferrocyanide (K4van Fe(CN)6) met Fe kationen, produceren een sterke blauwe kleur, en wordt gebruikt voor de detectie van de kwalitatieve ijzer in histologische secties van dierlijke en plantaardige weefsels.
Metalen (nul-valent) ijzer is zeldzaam in de lithosfeer. De dominante niet-complexvorm Ionische vorm van ijzer in het milieu is het meestal ingegeven door de hoeveelheid zuurstof in de omgeving, met Ferro ijzer wordt relatief meer overvloedig in zuurstofvrije omgevingen en ijzer(III) ijzer overheersen in aërobe sites. Deze laatste vorm is ook dominant in een zeer zure omgeving, hoewel het oorzakelijke agens van oxidatie van ijzer ijzer vaak in zuurstofvrije en zure omgeving18 verschillen. Wanneer ijzer is ontbindend in 4% HCl (pH = 0) in een aërobe omgeving, het grootste deel van het verdunde ijzer bestaat zoals de ijzer(III) (Fe3 +)19,20 vormen.
De reacties tussen Fe ionen en K4Fe(CN)6 zijn als volgt:
Fe3 +: FeCl3 + K4Fe(CN)6 KFe(III)Fe(II)(CN)6¯ + 3KCl =
Fe2 +: 4 FeCl2 + 2 K4Fe(CN)6 = Fe4(Fe(CN)6)2 + 8 KCl
In de huidige studie vroegen we of Pruisisch blauw kleuring kunnen nuttig zijn voor het meten van de niveaus van het ijzer in oplossing.
Aanvankelijk, gecontroleerd we de correlatie tussen de concentratie van Fe in waterige oplossing en Pruisisch blauw kleuring. De Fe (als FeCl2, FeCl3 of een mengsel van 1:1 van de twee) concentratie in waterige oplossingen werd zowel door atomaire spectroscopie extinctie (OD) gemeten na toevoeging van Pruisisch blauw. Figuur 1 toont de curven van de lineaire regressie voor metingen verkregen door elke methode. Wij geconcludeerd dat de Pruisisch blauw methode kan worden gebruikt voor de kwantitatieve analyse van ijzer-concentratie in de oplossing.
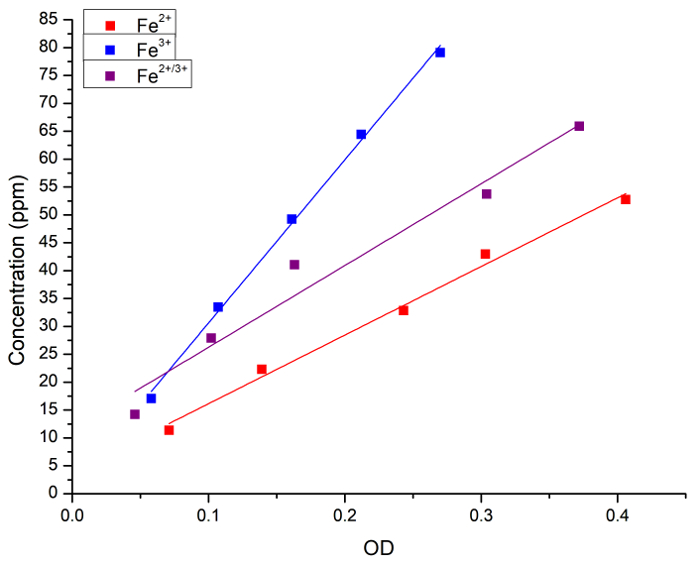
Figuur 1: lineaire regressies tussen Fe concentratie gemeten door FAAS en lichtabsorptie (OD, 715 nm) verkregen door de Pruisische blauwe methode. De blauwe vierkantjes en de lijn vertegenwoordigen de Fe2 + oplossing, de rode vierkantjes en de lijn vertegenwoordigen de Fe3 + oplossing en de zwarte vierkantjes en lijn vertegenwoordigen een 1:1-mengsel tussen Fe2 + en Fe3 +. De volgende regressies werden verkregen: [Fe2 +] = 3 + 123 x OD, r = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 x OD, r = 0.999, R2 = 0.997; en [Fe2 +/ 3 +] = 11 + 146 x OD, r = 0.983, R2 = 0.956. De Fe2 + donor was FeCl2 en de Fe3 + donor was FeCl3. Klik hier voor een grotere versie van dit cijfer.
Aan te passen de colorimetrische Pruisisch blauw methode voor kwantitatieve ijzer analyse van plantaardige weefsels, werd het ijzergehalte van tabak blad as gemeten door vlam atomaire absorptie spectroscopie en Pruisisch blauw kleuring. Er werd een goede correlatie tussen de resultaten van door de twee technieken.
Protocol
Representative Results
Discussion
Meting van de ijzer in plantaardige weefsels is zeer belangrijk voor de evaluatie van de effecten van irrigatie of andere omgevingsfactoren. We beschreven hier, een gemakkelijke en nauwkeurige colorimetrische methode voor Fe inhoud metingen in tabaksbladeren, die gemakkelijk aangepast aan andere plantensoorten en weefsels worden kan.
In het optimaliseren van voorwaarden voor de colorimetrische methode, gebruikten we een lage pH-medium (pH < 1.0) dat ijzer oplosbaarheid. Het brandproces werd ui…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dit werk werd gesteund door de Israël ministerie van wetenschap, technologie en Spaceand door een subsidie van de Chief Scientist van het Israëlische ministerie van landbouw (#16-16-0003).
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

