שיטה ערכי צבע מוחלטים למדידת תכולת ברזל צמחים
Summary
אנו מציגים פרוטוקול פשוטה ואמינה למדידת תוכן ברזל ברקמות הצמח באמצעות השיטה כחול פרוסי ערכי צבע מוחלטים.
Abstract
ברזל, אחד של יסודות קורט החשוב ביותר אורגניזמים חיים, מעורב תהליכים בסיסיים, כגון נשימה, פוטוסינתזה. תוכן ברזל הוא נמוכות למדי בכל היצורים, בהיקף של צמחים כ- 0.009 אחוז משקל יבש. עד כה, באחת השיטות המדויקות ביותר למדידת ריכוז ברזל ברקמות הצמח הוא הלהבה ספקטרום בליעה אטומית. עם זאת, גישה זו הוא יקרה ועתירת ואינה דורשת ציוד ספציפי לא נפוץ למצוא צמח מעבדות. לכן, דרושה שיטה פשוטה אך מדויקת יכול לשמש באופן שגרתי. השיטה כחול פרוסי ערכי צבע מוחלטים משמש באופן קבוע ברזל איכותי מכתים בסעיפים היסטולוגית מהחי והצומח. במחקר זה, שינינו את כחול פרוסי שיטת מדידות כמותיים של ברזל טבק עלים. נוכל לאמת את הדיוק של שיטה זו באמצעות ספקטרוסקופיה אטומית והן כחול פרוסי מכתים כדי למדוד את התוכן ברזל הדגימות באותו ומצא רגרסיה ליניארית (R2 = 0.988) בין שני ההליכים. אנו מסיקים כי השיטה כחול פרוסי למדידה כמותית ברזל ברקמות הצמח הוא מדויק, פשוטה וזולה. עם זאת, הרגרסיה הליניארית המובאת כאן לא ייתכן המתאים עבור מינים אחרים של הצמח, בשל פוטנציאל אינטראקציות בין המדגם הכימית. הקמתה של עיקול רגרסיה ובכך צורך עבור מינים שונים.
Introduction
הברזל (Fe) הוא micronutrient חשוב בכל היצורים החיים. בצמחים, זה micronutrient חיוני1 בגלל מעורבותה תהליכים בסיסיים, כגון נשימה, פוטוסינתזה, כלורופיל ביוסינטזה. הצטברות גבוהה של ברזל חינם יונים מזיק לשתול תאים עקב תגובות מוביל שחרור של רדיקלים חופשיים גורם סטרס חמצוני. כדי לשמור על הומאוסטזיס ברזל בתוך התא צמח, יונים המאוחסן וקואלות, מבודדות בתוך ferritins, חלבון הכלובים מעורבים ישירות הומאוסטזיס ברזל2 ומבנה האחסון העיקרי של ברזל בכל היצורים החיים. במקביל, אנמיה מחוסר ברזל משפיע על חלק ניכר של האוכלוסייה האנושית, וכתוצאה מכך הצורך הגובר צמח Fe biofortification. בשל תכונותיו הייחודיות של הצמח קשירת ברזל, העשרת מזון עם קשירת ברזל-ברזל מציע אסטרטגיה מבטיח להילחם בבעיה הזאת של תת-תזונה3.
יונים של ברזל הם בעיקר שנמצאו שתי חמצון מדינות, כלומר ברזלי (כלט Fe2 + או ברזל (II)), ferric (כ Fe3 + או ברזל (III)) טפסים. כמה צורות אחרות של ברזל, כגון ברזל אשכולות4, ניתן למצוא גם בתאים. Fe מאוחסן בתור תחמוצת ברזל בתוך התא, באופן טבעי צורות hematites (Fe2O3), ferryhidrites ((Fe3 +)2O3•0.5 H2O) תחת תנאים פיזיולוגיים5. והידרוקסידים שהוקמה ב תגובות אלו, במיוחד את הטופס ferric, יש מסיסות נמוכה מאוד. ברזל השמירה מושפע וכתוצאה מכך רמת ה-pH של התמיסה, במידה רבה במצב מוצק מעל pH 56.
בהתחשב המסיסות המסכן תגובתיות גבוהה של Fe, את ההעברה בין הצמח רקמות ואיברים חייב להיות מקושר עם מולקולות chelating מתאימים. יתר על כן, המדינות חמצון-חיזור בין צורות ומתכות ferric1 חייבים להיות מבוקרים. בתוך עלים, כ- 80% של הברזל הוא נמצא תאים פוטוסינתטיים, עקב שלה תפקידים חיוניים במערכת התחבורה אלקטרון, ביוסינטזה של cytochromes, כלורופיל, מולקולות אחרות heme, ואת היווצרות Fe-S אשכולות7. במקרה של ברזל עודף בתוך התא, העודף הוא translocated לתוך חלולית שבו המתכת מאוחסן בקשירת ברזל מולקולות8.
ניתן למדוד ברזל ברקמות הצמח על ידי מספר שיטות, כולל להבה בליעה אטומית ספקטרוסקופיה9 (FAAS) או מבחני ערכי צבע מוחלטים10, לשעבר להיות הרבה יותר מדויק מאשר לאחרון. FAAS היא טכניקה מאוד מדויקת המאפשר לנו לקבוע הרכב היסודות של מדגם על בסיס הפליטה האלקטרומגנטית של הרכיבים הבודדים. FAAS ממיר יונים מתכתיים למדינות אטומי מאת להבה-חימום של המדגם, המוביל עירור יון פליטה של גל מסוים יון נתון יחזור למצבו הקרקע. פליטת היונים שונה המופרדים באמצעות monochromator, זוהה על ידי חיישן הקליטה11. FAAS מגישה לכן ישירות לכמת ריכוזי ברזל. טכניקות אחרות המדגימה ברזל ברקמות ביולוגיות זמינים, אולם. מצמידים inductively פלזמה המוני ספקטרוסקופיה (ICP-MS)12 היא טכניקה מאוד מדוייק למדידת ברזל ויסודות קורט אחרים אבל העדר ציוד, גם FAAS וגם ICP-MS, היא בעיה נפוצה. מצד שני, ברזל המדידה על-ידי thiocyanate colorimetry13 חסר דיוק, לא יצליח לזהות וריאציות קטנות בין דגימות. כחול פרוסי מכתים14,15,16,17 היא שיטה עקיפה בהתבסס על התגובה של אשלגן ferric ferrocyanide (K4Fe(CN)6) עם קטיונים Fe, ייצור צבע כחול חזק, והוא משמש לזיהוי ברזל איכותי בסעיפים היסטולוגית של רקמות הגוף.
ברזל מתכתי (אפס-עמודים ולנטיין) הוא נדיר ליתוספירה. הצורה השלטת יוניים שאינם ומורכבת של ברזל בסביבת מוכתב בעיקר על ידי כמות החמצן בסביבה, עם ברזל ברזלי להיות יחסית שופע יותר בסביבות אנאוקסיים וברזל ferric predominating באתרים אירובי. זה באחרון גם הוא דומיננטי בסביבות מאוד חומצי, למרות הסוכנים סיבתי של ברזל ברזלי חמצון לעיתים קרובות נבדלים סביבה חומצית אנאוקסיים18. מתי ברזל solubilized ב 4% HCl (pH 0) בסביבה אירובית, החלק העיקרי של הברזל מדולל קיים כפי ferric הטופס (Fe3 +)19,20.
התגובות בין יונים Fe ו- K4Fe(CN)6 הן כדלקמן:
Fe3 +: FeCl3 + K-4-Fe(CN)-6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
Fe2 +: 4 FeCl2 + 2 K-4-Fe(CN)-6 = Fe4(Fe(CN)6)2 + 8 אשלגן כלורי
במחקר הנוכחי, ביקשנו אם צביעת כחול פרוסי יכול להיות שימושי עבור מדידת רמות ברזל בתמיסה.
בתחילה, נוכל לאמת את המתאם בין ריכוז Fe בתמיסה המימית מכתים כחול פרוסי. ריכוז Fe (כפי FeCl2, FeCl3 או תערובת של 1:1 של השני) בתחום פתרונות מימית נמדדה על ידי ספקטרוסקופיה אטומית והן על ידי ספיגת (OD) לאחר תוספת של כחול פרוסי. איור 1 מציג את עקומות רגרסיה ליניארית למדידות מתקבל על ידי כל שיטה. הגענו למסקנה כי השיטה כחול פרוסי יכול לשמש עבור ניתוח כמותי של ברזל ריכוז בתמיסה.
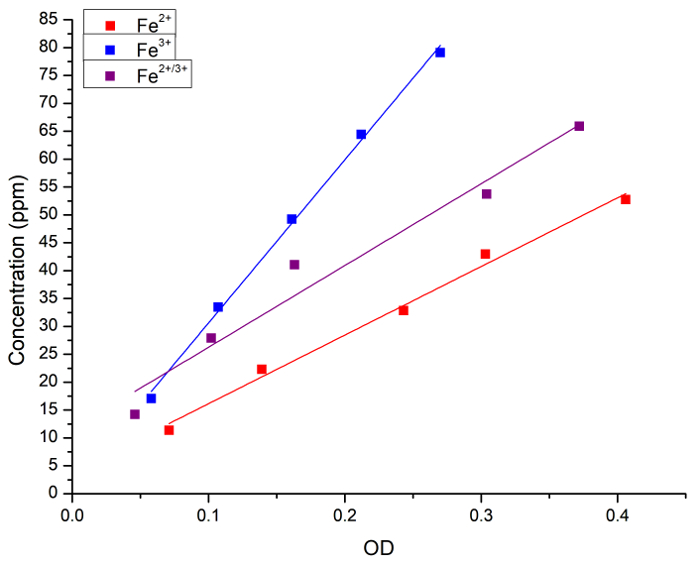
איור 1: regressions ליניארי בין ריכוז Fe נמדדת FAAS ואת ספיגת האור (OD, 715 ננומטר) מתקבל על ידי שיטת כחול פרוסי. ריבועים כחול וקו מייצג הפתרון2 + Fe, ריבועים אדומים וקו הפתרון3 + Fe מייצגים את ריבועים שחורים וקו מייצג תערובת 1:1 בין Fe2 + ו Fe3 +. Regressions הבאים התקבלו: [Fe2 +] = 3 + 123 x OD, r = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 x OD, r = 0.999, R2 = 0.997; ו [Fe2 + 3 +] = 11 + 146 x OD, r = 0.983, R2 = 0.956. התורם2 + Fe FeCl2 , היה התורם Fe3 + FeCl3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
להתאים את שיטת כחול פרוסי ערכי צבע מוחלטים לניתוח כמותי ברזל של רקמות הצמח, התוכן ברזל של האפר עלה טבק נמדדה על ידי להבה ספקטרום בליעה אטומית מכתים כחול פרוסי. היה מתאם טוב בין התוצאות של ידי שתי שיטות.
Protocol
Representative Results
Discussion
מדידה ברזל ברקמות הצמח חשוב מאוד להעריך את ההשפעות של השקיה או תנאים סביבתיים אחרים. כאן, אנחנו תיאר שיטה קלה ומדויקת ערכי צבע מוחלטים למדידה תוכן Fe טבק העלים, אשר ניתן להתאים בקלות מיני צמחים ורקמות אחרות.
תוך אופטימיזציה של תנאי עבור פעולת ערכי צבע מוחלטים, השתמשנו pH נמוך ב…
Divulgations
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי משרד המדע, הטכנולוגיה הלוהט על ידי מענק של המדען הראשי של משרד החקלאות (#16-16-0003).
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

