Ein kolorimetrischen Verfahren zur Messung der Eisengehalt in Pflanzen
Summary
Wir präsentieren Ihnen ein einfaches und zuverlässiges Protokoll zur Messung der Eisengehalt im Pflanzengewebe mit der kolorimetrischen Preußischblau-Methode.
Abstract
Eisen, eines der wichtigsten Mikronährstoffe in lebenden Organismen, engagiert sich in grundlegenden Prozesse, wie Atmung und Photosynthese. Gehalt an Eisen ist in allen Organismen, in Höhe von ca. 0,009 % Trockensubstanz in Pflanzen eher gering. Bis heute ist eine der genauesten Methoden zur Messung der Eisenkonzentration im Pflanzengewebe Flamme Absorption Atomspektroskopie. Aber dieser Ansatz ist zeitaufwändig und teuer und erfordert speziellen Geräte, die in Anlage Labors nicht häufig zu finden. Daher braucht man eine einfachere, aber genaue Methode, die routinemäßig eingesetzt werden kann. Die farbmetrische Preußischblau Methode wird regelmäßig für qualitative Eisen Färbung in Tier- und histologischen Abschnitte verwendet. In dieser Studie haben wir die Preußischblau Methode zur quantitativen Messungen des Eisens im Tabak Blätter angepasst. Wir überprüft die Genauigkeit dieser Methode mit Atomspektroskopie und Preußischblau beflecken, zum Messen der Eisengehalt in den gleichen Proben und fand eine lineare Regression (R2 = 0.988) zwischen den beiden Verfahren. Wir schlussfolgern, dass die Preußischblau Methode zur quantitativen Eisen-Messung im Pflanzengewebe präzise, einfach und kostengünstig ist. Die lineare Regression, die hier vorgestellten möglicherweise jedoch nicht geeignet für andere Pflanzenarten, wegen möglicher Wechselwirkungen zwischen der Probe und Reagenz. Einrichtung einer Regression Kurve benötigt somit für verschiedene Pflanzenarten.
Introduction
Eisen (Fe) ist ein wichtiger Mikronährstoff in allen lebenden Organismen. In Pflanzen ist es ein wesentlicher Mikronährstoff-1 wegen seiner Beteiligung an grundlegenden Prozesse, wie Atmung, Photosynthese und Chlorophyll Biosynthese. Hohe Ansammlung von freien Eisenionen ist schädlich für die Pflanzenzellen durch Reaktionen führt zur Freisetzung von freien Radikalen verursacht oxidativen Stress. Um Eisen in der Pflanzenzelle Homöostase sind Ionen in Vakuolen gespeichert und innerhalb Ferritins, Protein Käfige direkt beteiligt sind Eisen-Homöostase-2 und der wichtigsten Speicherstruktur von Eisen in allen lebenden Organismen abgesondert. Zur gleichen Zeit betrifft Eisenmangel Anämie einen Großteil der menschlichen Bevölkerung, was zu einem steigenden Bedarf an Anlage Fe biofortifikation. Aufgrund der einzigartigen Eigenschaften der Pflanze Ferritin bietet Essen Anreicherung mit Ferritin-Eisen eine vielversprechende Strategie zur Bekämpfung dieses Problems der Unterernährung3.
Eisen-Ionen sind hauptsächlich gefunden in zwei Oxidationsstufen, nämlich dem Eisen (zweiwertigen Fe2 + oder Eisen (II)) und Eisen (dreiwertiges Fe3 + oder Eisen (III)) Formen. Verschiedene andere Formen von Eisen, z. B. Eisen-Cluster4, finden sich auch in den Zellen. FE wird gespeichert als Eisenoxid innerhalb der Zelle und natürlich Formen Hematites (Fe2O3) und Ferryhidrites ((Fe3 +)2O3•0.5 H2O) unter physiologischen Bedingungen5. Die hydroxide gebildet in diesen Reaktionen, vor allem Eisen Form, haben sehr geringe Löslichkeit. Eisen-Aufbewahrung richtet sich daher nach den pH-Wert der Lösung und ist weitgehend in einen festen Zustand über pH 5-6.
Angesichts der schlechten Löslichkeit und hohe Reaktivität der Fe muss die Übertragung unter den pflanzlichen Geweben und Organen geeignete Komplexbildner Moleküle zugeordnet werden. Darüber hinaus müssen die Redox-Staaten zwischen dem Eisen und Eisen Formen1 gesteuert werden. In Blätter etwa 80 % des Eisens findet sich in photosynthetischen Zellen durch seine wesentliche Rollen in das elektronentransportsystem, bei der Biosynthese von Zellfarbstoffe, Chlorophyll und anderen Häm-Moleküle, und bei der Bildung von Fe-S-Cluster7. Im Falle von Eisen Übermaß innerhalb der Zelle ist der Überschuss in die Vakuole umgesiedelt, wo das Metall in Ferritin-Moleküle8gespeichert ist.
Eisen kann durch mehrere Methoden, einschließlich Flamme Atom-Absorptions-Spektroskopie9 (FAAS) oder farbmetrische Assays10, das ehemalige sein viel präziser als die letzteren in Pflanzengeweben gemessen werden. FAAS ist eine hochpräzise Technik, mit der man die elementare Zusammensetzung einer Probe auf der Grundlage der elektromagnetischen Emissionen der einzelnen Elemente bestimmen kann. FAAS konvertiert Metallionen in Zustände durch Flamme erhitzen der Probe, was zu Ionen-Anregung und Emission einer bestimmten Wellenlänge, wenn eine bestimmte Ion in seinem Grundzustand zurückkehrt. Die Emissionen aus den verschiedenen Ionen sind getrennt durch einen Monochromator und durch Absorption Sensor11erkannt. FAAS dient somit direkt Eisen-Konzentrationen zu quantifizieren. Andere Techniken zur Visualisierung von Eisen in biologischen Geweben sind jedoch verfügbar. Induktiv-gekoppelte Plasma-Massenspektrometrie (ICP-MS)12 ist eine sehr präzise Technik zur Messung von Eisen und anderen Spurenelementen, sondern der Mangel an Ausrüstung, sowohl für FAAS und ICP-MS, ist ein häufiges Problem. Auf der anderen Seite Eisen Messung von Thiocyanat Farbmetrik13 nicht präzise genug und nicht geringe Schwankungen zwischen Proben erkennt. Preußischen blaue Färbung14,15,16,17 ist eine indirekte Methode basiert auf der Reaktion von dreiwertigem Kaliumferrocyanid (K4Fe(CN)6) mit Fe-kationen, produzieren ein starke blaue Farbe, und dient zur qualitativen Eisen-Erkennung in histologischen Abschnitten von tierischen und pflanzlichen Geweben.
Metallic (null-Valent) Eisen ist selten in der Lithosphäre. Die dominierende nicht komplexiert Ionische Form des Eisens in der Umgebung richtet sich vor allem durch die Menge an Sauerstoff in der Umgebung mit Eisen Eisen als relativ häufiger in anoxischen Umgebungen und dreiwertigem Eisen überwiegt in aeroben Websites. Diese letztere Form ist auch in extrem sauren Umgebungen, dominierend, obwohl die Erreger der eisenhaltige Eisenoxidation oft in anoxischen und sauren Umgebung18unterscheiden. Wenn Eisen ist in 4 % solubilisiert HCl (pH 0) in einer aeroben Umgebung, der Großteil der verdünnten Eisen vorhanden ist, als das Eisen (Fe3 +)19,20bilden.
Die Reaktionen zwischen Fe-Ionen und K4Fe(CN)6 lauten wie folgt:
FE3 +: FeCl3 + K4Fe(CN)6 = KFe(III)Fe(II)(CN)6¯ + 3KCl
FE2 +: 4 FeCl2 + 2 K4Fe(CN)6 Fe4(Fe(CN)6)2 + 8 = KCl
In der vorliegenden Studie fragten wir ob preußischen Blaufärbung zur Messung der Eisengehalt in Lösung nützlich sein kann.
Wir überprüft zunächst die Korrelation zwischen der Konzentration von Fe in wässriger Lösung und preußischen Blaufärbung. Die Fe (als FeCl2, FeCl3 oder ein 1:1 Mischung aus beidem) Konzentration in wässrigen Lösungen wurde sowohl durch Atomspektroskopie Extinktion (OD) nach Zugabe von Preußischblau gemessen. Abbildung 1 zeigt die lineare Regression-Kurven für Messungen von jeder Methode. Wir festgestellt, dass die preußische blaue Methode zur quantitativen Analyse von Eisen-Konzentration in der Lösung verwendet werden kann.
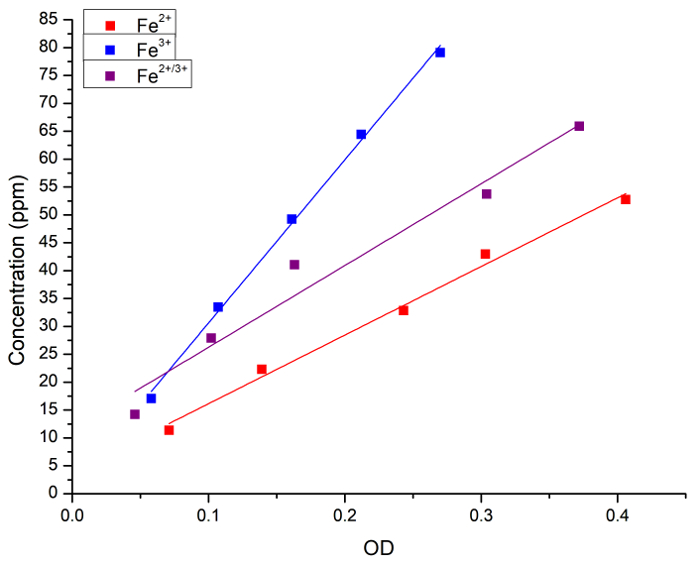
Abbildung 1: lineare Regressionen zwischen Fe-Konzentration gemessen an FAAS und leichte Extinktion (OD, 715 nm) durch die preußische blau-Methode erhalten. Die blauen Quadrate und Linie stellen die Fe2 + Lösung dar, die roten Quadrate und Linie repräsentieren die Fe3 + Lösung und die schwarzen Quadrate und Linie repräsentieren eine 1:1 Mischung aus Fe2 + und Fe3 +. Die folgenden Regressionen wurden erzielt: [Fe2 +] = 3 + 123 X OD, R = 0.996, R2 = 0.989; [Fe3 +] = 1 + 292 X OD, R = 0,999, R2 = 0.997; und [Fe2 + / 3 +] = 11 + 146 X OD, R = 0.983, R2 = 0.956. Fe2 + Spender war FeCl2 und Fe3 + Spender war FeCl3. Bitte klicken Sie hier für eine größere Version dieser Figur.
Um die farbmetrischen preußische blau Methode für quantitative Eisen Analyse von Pflanzengewebe anzupassen, war der Eisengehalt von Tabak Blatt Asche gemessen Flamme Absorption Atomspektroskopie und preußischen Blaufärbung. Es gab gute Korrelation zwischen den Ergebnissen aus durch die beiden Techniken.
Protocol
Representative Results
Discussion
Eisen-Messung im Pflanzengewebe ist sehr wichtig für die Bewertung der Auswirkungen der Bewässerung oder andere Umweltbedingungen. Wir hier eine einfache und genaue kolorimetrischen Verfahren zur Fe Content Messung in Tabakblättern, die ohne weiteres auf andere Pflanzenarten und Gewebe angepasst werden können.
Bedingungen für die kolorimetrischen Verfahren zu optimieren, haben wir einen niedrigen pH-Wert Medium (pH < 1.0) um Eisen Löslichkeit zu ermöglichen. Der Brennvorgang wurde durch…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch einen Zuschuss aus dem Hauptamt des israelischen Ministeriums für Landwirtschaft (#16-16-0003) von Israel Ministerium für Wissenschaft, Technologie und Spaceand unterstützt.
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

