التحفيز الكهربائية والميكانيكية المتزامنة لتعزيز إمكانات كارديوميوجينيك الخلايا
Summary
نقدم هنا بروتوكولا لتدريب سكان خلية استخدام المحفزات الكهربائية والميكانيكية محاكاة فسيولوجيا القلب. هذا التحفيز الكهروميكانيكية يعزز إمكانات كارديوميوجينيك الخلايا المعالجة وهو استراتيجية واعدة لزيادة العلاج بالخلايا، والنمذجة المرض، وفحص المخدرات.
Abstract
أمراض القلب والأوعية الدموية هي السبب الرئيسي للوفاة في البلدان المتقدمة النمو. ونتيجة لذلك، قد حفز الطلب على العلاجات الفعالة خلية القلب الباحثين في مجالات الهندسة الحيوية والخلايا الجذعية لتطوير في المختبر عالية الدقة البشري عضلة القلب لكل من البحوث الأساسية والتطبيقات السريرية. ومع ذلك، هو النمط الظاهري غير ناضجة من خلايا القلب قيداً على الحصول على الأنسجة التي تحاكي وظيفيا في عضلة القلب الكبار، الذي يتسم أساسا بالإشارات الميكانيكية والكهربائية. وهكذا، والغرض من هذا البروتوكول هو إعداد وتنضج السكان الخلية المستهدفة عن طريق تحفيز الكهروميكانيكية، تلخيصا المعلمات الفسيولوجية. هندسة الأنسجة القلبية وتتطور نحو المزيد من النهج البيولوجية، واستراتيجيات تستند إلى المنبهات الفيزيائية، ومن ثم، تكتسب زخما. الجهاز لهذا الغرض هي فريدة من نوعها ويسمح التحفيز الكهربائية والميكانيكية فردية أو متزامنة، تتميز بعناية والتحقق من صحتها. على الرغم من أن قد تم تحسين المنهجية لهذا مشجعا وعدد سكانها خلية معينة، بالإضافة إلى ذلك، يمكن بسهولة أن تتكيف خطوط الخلايا والأجهزة الأخرى. وتوفر النتائج هنا دليلاً على التزام القلب زيادة السكان خلية بعد التحفيز الكهروميكانيكية. إظهار الخلايا اليكتروميتشانيكالي حفز تعبير زيادة علامات القلب الرئيسية، بما في ذلك الجينات المبكرة والهيكلية، وتنظم الكالسيوم. ويمكن تكييف هذه الخلية مفيدة لمواصلة العلاج بالخلايا التجديدي، والنمذجة المرض، وفحص المخدرات الفائق.
Introduction
وتستند وظيفة القلب اقتران الإثارة الكهربائية والميكانيكية الانكماش. باختصار، تسمح الوصلات بين الخلايا كارديوميوسيتي نشر الإشارة الكهربائية لإنتاج تقلصات متزامنة تقريبا من القلب أن ضخ الدم النظامية، ومن خلال نظام الرئوية. وهكذا تخضع خلايا القلب، القوى الكهربائية والميكانيكية التي تنظم وظيفة الجينات الخلوية والتعبير. وبناء على ذلك، حاول العديد من المجموعات تطوير منصات الثقافة التي تحاكي البيئة الفيزيولوجية القلب لفهم دور التحفيز الميكانيكية والكهربائية في التنمية القلب والدالة، ونضج. في المختبر الكهربائية والميكانيكية التحفيز على حدة قد طبقت على نطاق واسع في هندسة الأنسجة القلبية لتعزيز الخصائص الفنية، وزيادة نضوج الخلية، أو تحسين اقتران خلية خلية والكالسيوم مناولة1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21-غير تكييف الكهروميكانيكية متزامن لا تزال غير مستغلة بسبب التحدي المتمثل في وضع مشجعا والبروتوكول، وبسبب التحسين الإلزامي22.
تناولت أعمال أولية التحفيز الكهروميكانيكية كمزيج من التحفيز الكهربائي ونضح وسائط الإعلام؛ ومع ذلك، لا تنطوي على التدفق تشوه على أساس السلالة النموذجية لملء البطين23،،من2425. في وقت لاحق، المزيد من النهج الفسيولوجية مجتمعة المحفزات الكهربائية مع التشوه البدني أو امتداد لتقليد isovolumetric انكماش26،27،،من2829،30 ،31. فينغ et al. ووصف المظاهرة الأولى من التحفيز للمقاولات في عام 2005، الإبلاغ عن تعزيز خصائص الحجم والهوس كارديوميوسيتي26. وانغ pretreated الخلايا الجذعية الوسيطة مع 5-أزاسيتيديني et al. وتطبق المتزامنة تكييف الكهربائية والميكانيكية، وتحسين ريسيلولاريزيشن وبقاء الخلية، وتمايز القلب والأنسجة إعادة عرض27. منذ تلك المنشورات، قد ذكرت في حفز الكهروميكانيكية مونولاييرس الخلية المزيد من المجموعات أو هندسة الأنسجة (مثل الأسود28نوفاكوفيتش فانيك29،31، ولدينا مجموعة30) مع اختبار الخلايا مكيفة أول المجراة في30. بإيجاز، اختبر مورغان والأسود العديد من تركيبات من المحفزات الكهربائية والميكانيكية، الإبلاغ عن أن التوقيت بين التحفيز أمر حاسم نظراً لتأخر التحفيز الكهروميكانيكية مجتمعة تسفر عن نتائج أفضل28. بعد ذلك، جودير-Furnémont والمتعاونين الأمثل بروتوكولا تحفيز الكهروميكانيكية لثوابت عضلة القلب هندسيا من خلايا القلب الفئران حديثي الولادة وتحقيقه، للمرة الأولى، علاقة إيجابية قوة تردد29. بعد ذلك، ذكرت مجموعتنا أن الخلايا اليكتروميتشانيكالي اشترطت زيادة التعبير عن علامات القلب الرئيسي في المختبر وقاعدة عريضة مفيدة تأثيرات المجراة في، مثل تحسين وظيفة القلب أو زيادة كثافة السفينة في احتشاء المنطقة الحدودية30. نشر مؤخرا أظهرت تعرض أنسجة القلب من كارديوميوسيتيس المستمدة من الخلايا الجذعية لتكييف الكهروميكانيكية الذي تم التوصل إليه نضج مستوى أقرب إلى البشرية الكبار القلب هيكل ووظيفة31. بالإضافة إلى ذلك، تشمل منصات بديلة التحفيز ثلاثي الأبعاد السقالات اليكترواكتيفي التي توفر الكهربائية والميكانيكية، والإشارات الطوبوغرافية للخلايا تعلق32. وعلاوة على ذلك، يمكن أيضا الناجم عن تشوه الميكانيكية (خلية أحادي الطبقة وضغط الشارع) مع أقطاب المط محاكاة الظروف الفسيولوجية العادية، فضلا عن الظروف القاسية33.
ولذلك، والأساس المنطقي أن المحفزات الكهروميكانيكية في المختبر على أساس الظروف الفسيولوجية يمكن أن تعزز إمكانات كارديوميوجينيك خلية. في الواقع، هذا التحفيز يمكن أن تستفيد كذلك التكاملات الخلايا العلاجية في عضلة القلب في سيناريو السريري أو زيادة نضوج الأنسجة للمخدرات-فحص الطلبات.
وبالإضافة إلى ذلك، نحن معزولة ويتسم أن خلايا البشرية السلف المستمدة من الأنسجة الدهنية للقلب المنشأ (أتدبكس القلب)34. وتقع هذه الخلايا في الدهون ابيكارديال. هذه الخلايا تعرض تأثيرات نسيجية ووظيفية مفيدة في علاج احتشاء عضلة القلب وأيضا الحفاظ على التمايز القلب وبطانية المحتملة. 30 , 35-افترضنا أن هذه الفوائد ستزيد بعد التحفيز الفيزيائية الأحيائية.
ونتيجة لذلك، علينا وضع جهاز ونظام تحفيز للسكان خلية من الاهتمام والتحقيق الآثار. هذا البروتوكول الكهروميكانيكية هو استراتيجية جديدة للحث على الخلية النشطة التي تمتد بطريقة عقيمة ونونينفاسيفيلي بالمقارنة مع السابق منشورات36، في تركيبة مع تنشيط الحقل الكهربائي. الأسلوب الذي ذكرته هنا يشرح بالتفصيل الجهاز والطريقة المستخدمة لتحفيز الخلايا الكهربائية والميكانيكية والكهروميكانيكية.
هذا الجهاز يمكن أن توفر التحفيز الكهربائية والميكانيكية على حد سواء، بشكل مستقل أو في نفس الوقت. يتم التنشيط مع نهج جديد موسع والعقيم الذي يتضمن دعم الخلية بريستيريليزيد، أقطاب توضع داخل لوحة ثقافة قياسية، والنظام الأساسي الذي يدفع القوات الميكانيكية والكهربائية (الشكل 1).
يمكن أن تعقد المنصة تصل إلى ثقافة ست لوحات ويتكون هيكل ساندويتش poly(methyl methacrylate) الليزر قطع وقطع الدوائر المطبوعة-المجلس. النموذج الأولى للنظام الأساسي يعتمد على مزيج من أحادية الطور للبرمجة الكمبيوتر التي تسيطر عليها الكهربائية مشجعا، لوحة دائرة مطبوعة لاتصال قوي كهربائي، وستة 10 مم × 10 مم × 5 مم مطلية ثابتة نيوديميوم مغناطيس توضع القرب من جانب واحد من ألواح الثقافة. وهناك أيضا قضيب من ألمنيوم مع المغناطيس دافعة ستة (النموذج نفسه) وضعت أمام الجانب الآخر من لوحات الثقافة وانتقلت مع سيرفوموتور خطية. المحرك مدفوعة من قبل وحدة تحكم محرك، تعمل من خلال منفذ RS 232 بالبرمجيات التجارية (انظر الجدول للمواد). من خلال واجهة المستخدم ومشجعا للبرمجة، فمن الممكن لبرنامج كثافة الكهربائية، مدة النبضة والتردد، وتواتر التحفيز الميكانيكي، دورة العمل، والعدد من البقول، مطال النبض (رحلة المغناطيس)، والمنحدر.
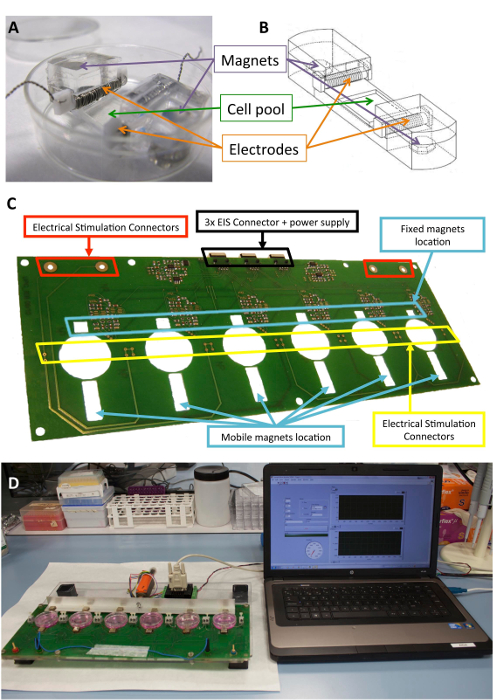
الشكل 1 : مشجعا الكهروميكانيكية. (أ) PDMS بناء المستخدمة لتكييف الخلية. (ب) الرسم بناء PDMS، بما في ذلك الأقطاب الكهربائية وقطع المغناطيس. (ج) تفصيل الدوائر المطبوعة المجلس (منصة) المستخدمة لأداء التكييف الكهروميكانيكية. وقد تم تعديل هذا الفريق من Llucià-فالديبيراس et al.30. (د) صورة لواجهة المستخدم ومنصة التحفيز الكهروميكانيكية (الكمبيوتر). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
ويرد وصف كامل مشجعا وطريقة لتكييف الكهروميكانيكية في براءات الاختراع الدولية اثنين و WO-2013185818-A137 و WO-2017125159-A138.
سيليكون متوافق حيويا وكانت مصممة لتوفير الدعم الهيكلي للخلايا واقطاب المغناطيس بنيات الموصوفة سابقا10،21. بإيجاز، وهي تتألف من بولي دايمثيل سيلوكسان (PDMS)، مصبوب وعلاجه في درجة حرارة الغرفة، مع معامل الشباب 1.3 الآلام والكروب الذهنية، قريبة من المستويات الفسيولوجية. يحتوي على بنية تجمع ثقافة خلية في منطقة مرنة (10 مم × 10 مم × 2 مم)، فتحتا عرضية الداخلية عقد أقطاب كهربائية، واثنين المضمنة 6 مم × 2 مم × 4 مم مطلية نيوديميوم المغناطيس. أقطاب كهربائية يتم بناؤها مع 0.2 مم البلاتين الأسلاك الملتوية حول 2 مم × 3 مم × 12 مم تترافلوروايثيلين (PTFE) الأساسية بار (21 سم كل قطب، يتحول نحو 23) وتوضع على طرفي نقيض من منطقة مرنة تهيئة مجال الكهربائي لحمل التحفيز الكهربائي. تمتد الميكانيكية يتحقق من خلال الجذب المغناطيسية بين المغناطيس جزءا لا يتجزأ من الدعم والمغناطيس الخارجي بجوار لوحة الثقافة وعلى الذراع الألومنيوم تتحرك. وبهذه الطريقة، يمكن تمديد دعم الخلية دون كسر الحاجز العقيمة. هذا النهج مناسب لأحادي الطبقة خلية لكن يمكن تكييفه لثوابت ثلاثي الأبعاد، كذلك.
وبالإضافة إلى ذلك، يمكن أن تكون نمطاً منتظما مطبوع حيث يتم المصنف الخلايا، قضت حيود [غرتينغ] (1,250 الأخاديد في مم) باستخدام. التصور مباشرة من الخلايا المستزرعة في بناء PDMS تحت برايتفيلد ومجاهر الفلورسنت ممكن بسبب شفافيته وسمك 0.5 مم. في هذه الحالة، قد تجمع الثقافة PDMS نمط سطح رأسي، عمودي على القوة تمتد محاذاة الخلايا عمودياً إلى الحقل الكهربائي، مما يقلل من التدرج الحقل الكهربائي عبر الخلية.
ويبين الشكل 1 وصفاً مفصلاً لبناء والجهاز المستخدم للتنشيط. بناء PDMS والخصائص هي الأمثل للخلية تمتد (الشكل 1 أ، ب). مشجعا البلدان المتقدمة النمو والتحقق من صحتها للتطبيق الفعال لتحفيز الكهربائية والميكانيكية المطلوبة للخلايا المرتبطة ببناء PDMS. وتشمل هذه العملية ضمان قابلية التشغيل المستخدم واتصال جيدة من خلال واجهة البرنامج (الشكل 1، د).
يرد وصف للإجراءات لتحفيز الخلية باستخدام هذا الجهاز مصنوعة خصيصا في قسم البروتوكول.
Protocol
Representative Results
Discussion
التحفيز للمقاولات، على ما يبدو، بديلاً أمنا لإعداد الخلايا لبيئة معادية القلب وتعزيز التزامهم بالقلب. هنا، ذكرت بروتوكول وصف خلايا القلب السلف زيادة التعبير عن علامات القلب الرئيسي وهو أن تكون مفيدة لما زرع القادم في عضلة القلب مورين إينفاركتيد30. بشكل عام، أتدبكس القلب اليك…
Divulgations
The authors have nothing to disclose.
Acknowledgements
الكتاب أريد أن أشكر أعضاء “برنامج البحوث إيكريك” (إيجتب، بادالونا) الإلكتروني ومجموعة الأجهزة الطبية الحيوية (اتحاد الوطنيين الكونغوليين، برشلونة)، خاصة الأستاذ J. روسيل فيرير. وبالإضافة إلى ذلك، تقر الكتاب مجلة “الطب متعدية” الخلايا الجذعية والصحافة الفاميد للسماح بتكييف الأرقام المنشورة سابقا (Llucià-فالديبيراس, et al. 30)-تطوير هذا النموذج وتصميم البروتوكول كانت تدعمها وزارة التعليم ص العلوم (القوات المسلحة السودانية 2008-05144)، وزارة الاقتصاد دي y كومبيتيتيفيداد (القوات المسلحة السودانية 2014-59892)، “المفوضية الأوروبية” (البرنامج الإطاري السابع ريكاتابي، NMP3-SL-2009-229239)، المؤسسات La Marató de TV3 (080330، 201516، 201502)، ومؤسسة الفقرة la Innovación y la بروسبيكتيفا en السعود في إسبانيا (فيبسي؛ 06-00001396-15).
Materials
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2X | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
References
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium’s electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology–Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).

