Gelijktijdige elektrische en mechanische stimulatie ter verbetering van de cellen Cardiomyogenic potentieel
Summary
Hier presenteren we een protocol voor de opleiding van de bevolking van een cel met behulp van elektrische en mechanische stimuli emuleren cardiale fysiologie. Deze elektromechanische stimulatie verbetert het cardiomyogenic potentieel van de behandelde cellen en is een veelbelovende strategie voor verdere celtherapie, ziekte modellering en drug screening.
Abstract
Cardiovasculaire aandoeningen zijn de belangrijkste doodsoorzaak in de ontwikkelde landen. Bijgevolg heeft de vraag naar effectieve cardiale celtherapieën gemotiveerd onderzoekers in de cel van de stam en bioengineering velden te ontwikkelen in vitro HiFi-menselijke myocard voor zowel basisonderzoek en klinische toepassingen. De onrijpe fenotype van hartcellen is echter een beperking op het verkrijgen van weefsels die functioneel na te bootsen de volwassen myocard, dat vooral wordt gekenmerkt door mechanische en elektrische signalen. Het doel van dit protocol is dus, voor te bereiden en oudere van de cel doelgroep door middel van elektromechanische stimulatie, Recapitulerend fysiologische parameters. Cardiale weefselengineering evolueert naar meer biologische benaderingen en strategieën op basis van biofysische stimuli, dus, zijn goed op stoom. Het apparaat ontwikkeld voor dit doel is uniek en kan afzonderlijk of gelijktijdig elektrische en mechanische stimulatie, zorgvuldig gekenmerkt en gevalideerd. Bovendien, hoewel de methode is geoptimaliseerd voor deze stimulator en de bevolking van een specifiek cel, kan het gemakkelijk worden aangepast aan andere apparaten en cellijnen. De resultaten hier bieden bewijs van de toegenomen cardiale verbintenis de celpopulatie na elektromechanische stimulatie. Electromechanically gestimuleerd cellen tonen een verhoogde expressie van belangrijkste cardiale markers, met inbegrip van vroege, structurele en calcium-regulering genen. Deze cel conditionering kan nuttig zijn voor verdere regeneratieve celtherapie, ziekte modelleren, en high-throughput drug screening.
Introduction
Hartfunctie is gebaseerd op de koppeling van elektrische excitatie en contractie van de mechanische. Kort, cardiomyocyte intercellulaire kruispunten toestaan elektrische signaal doorgeven aan het produceren van bijna synchrone contracties van het hart dat bloed pomp, systemisch en via het pulmonaire systeem. Hartcellen, ondergaan dus zowel elektrische en mechanische krachten die regelen van gen expressie en cellulaire functie. Dienovereenkomstig, vele groepen hebben geprobeerd te ontwikkelen cultuur platformen die de cardiale fysiologische omgeving om te begrijpen van de rol van mechanische en elektrische stimulatie op cardiale ontwikkeling, functie en rijping na te bootsen. In vitro elektrische en mechanische stimulaties individueel toegepaste uitgebreid in cardiale weefselengineering functionele eigenschappen verbeteren, cel rijping vergroten of verbeteren cel koppeling en calcium behandeling1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. synchrone elektromechanische conditionering blijft echter onbenut vanwege de uitdaging van de ontwikkeling van een stimulator en protocol, en de verplichte optimalisatie22.
Voorbereidende werkzaamheden gericht elektromechanische stimulatie als een combinatie van elektrische stimulatie en media perfusie; de stroom gaat echter niet om de stam gebaseerde vervorming typische van ventriculaire vulling23,24,25. Later meer fysiologische benaderingen elektrische prikkels gecombineerd met fysieke vervorming of uitrekken om na te bootsen de isovolumetric contractie26,27,28,29,30 ,31. Feng et al. beschreef de eerste demonstratie van elektromechanische stimulatie in 2005, rapportage cardiomyocyte grootte en contractiele eigenschappen26verbeterd. Wang et al. mesenchymale stamcellen met 5-azacytidine voorbehandeld en gelijktijdige elektrische en mechanische conditionering, verbetering van de recellularization, levensvatbaarheid van de cellen, cardiale differentiatie en weefsel remodeling27toegepast. Sinds die publicaties, meer groepen hebben gemeld op elektromechanische stimulatie van cel monolayers of weefsels (bijvoorbeeld zwart28Vunjak-Novakovic29,31, en onze fractie30) ontworpen met de eerste geconditioneerde cellen getest in vivo30. Kort, Morgan en zwart getest verschillende combinaties van elektrische en mechanische stimuli, melden dat de timing tussen stimulaties was van cruciaal belang omdat vertraagde gecombineerde elektromechanische stimulatie de beste resultaten-28 leverde. Vervolgens Godier-Furnémont en medewerkers geoptimaliseerd een elektromechanische stimulatie-protocol voor de gemanipuleerde hart spier constructies van neonatale rat hart cellen en bereikt, voor de eerste keer, een positieve kracht-frequentie relatie29. Daarna, onze fractie gerapporteerd dat electromechanically geconditioneerde cellen verhoogd de uitdrukking van de belangrijkste cardiale markeringen in vitro en brede gunstige effecten in vivo, zoals verbeterde cardiale functie of toegenomen dichtheid van het vaartuig in het infarct grens regio30. De meest recente publicatie aangetoond dat cardiale weefsels uit stamcellen-cell-derived cardiomyocytes aan elektromechanische conditionering bereikt een rijping niveau dichter bij menselijke volwassen cardiale structuur en functie31 onderworpen. Bovendien, alternatieve driedimensionale stimulatie platformen omvatten electroactive steigers waarmee de elektrische, mechanische en topografische signalen naar de cellen gekoppeld32. Mechanische vervorming (cel enkelgelaagde uitrekken en compressie) kan bovendien ook worden opgewekt met elastische elektroden nabootsen van normale fysiologische omstandigheden, evenals extreme omstandigheden33.
De grondgedachte is derhalve dat in vitro elektromechanische prikkels op basis van fysiologische omstandigheden zou kunnen het potentieel van de cardiomyogenic van een cel vergroten. Inderdaad, deze stimulatie kan profiteren verder integraties van therapeutische cellen in het myocardium in een klinische scenario of weefsel rijping voor drug-screening toepassingen te verhogen.
Bovendien, we geïsoleerd en een bevolking van menselijk vetweefsel afkomstige voorlopercellen van cardiale gekenmerkt oorsprong (cardiale ATDPCs)34. Deze cellen bevinden zich in het epicardial vet. Deze cellen weergeven histopathologisch en functionele voordelen bij de behandeling van een hartinfarct en ook het onderhouden van cardiale en endotheel differentiatie potentiële. 30 , 35. wij veronderstelde dat deze voordelen na biofysische stimulatie verhogen zou.
Dus we ontwikkelde een apparaat en een regeling van de stimulatie voor de bevolking van de cel van belang en onderzocht de effecten. Dit elektromechanische protocol is een nieuwe strategie voor het opwekken van actieve cel die zich uitstrekt in een steriele wijze en noninvasively vergeleken met eerdere publicaties36, in combinatie met elektrische veld stimulatie. De techniek hier gemeld wordt uitgelegd in detail het apparaat en de methode die wordt gebruikt voor de elektrische, mechanische en elektromechanische stimulatie van cellen.
Dit apparaat kan bieden zowel elektrische en mechanische stimulatie, onafhankelijk of gelijktijdig. De stimulatie wordt uitgevoerd met een noninvasive en aseptische nieuwe benadering, die presterilized cel ondersteunt, elektroden geplaatst binnen een standaard cultuur plaat, en een platform dat induceert de mechanische en elektrische krachten (Figuur 1).
Het platform kan houden tot zes cultuur platen en bestaat uit een sandwich constructie van laser-gesneden poly(methyl methacrylate) en printplaat stukken. Het prototype platform is gebaseerd op een combinatie van een monofasische programmeerbare computer gestuurde elektrische stimulator, een Printplaat voor de robuuste aansluiting van de elektroden, en zes 10 mm x 10 x 5 mm vernikkeld neodymium-vaste magneten geplaatst in de buurt van de één-kant van de platen van de cultuur. Er is ook een aluminium bar met zes drijvende magneten (hetzelfde model) voor de andere kant van de cultuur-platen geplaatst en vertrok met een lineaire servomotor. De motor wordt aangedreven door een motorcontroller, beheerd via een RS-232 poort door commerciële software (Zie de Tabel van de materialen). Via de gebruikersinterface en programmeerbare stimulator is het mogelijk om te programmeren van de elektrische intensiteit, de impulstijd en frequentie, de frequentie van mechanische stimulatie, de taakcyclus, het aantal pulsen, de amplitude van de pols (magneet excursie), en de helling.
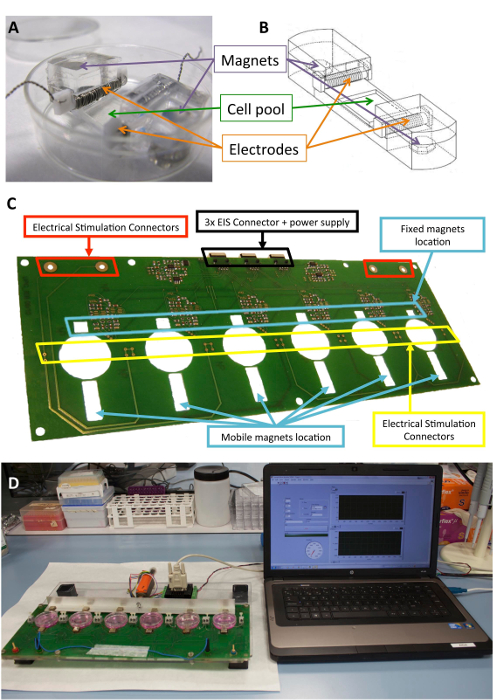
Figuur 1 : Elektromechanische stimulator. (A) PDMS-constructie voor de conditionering van de cel gebruikt. (B) een tekening van het PDMS construct, met inbegrip van de elektroden en magneten. (C) Detail van de printplaat (platform) gebruikt voor het uitvoeren van de elektromechanische conditionering. Dit paneel is gewijzigd van Llucià-Valldeperas et al.30. (D) foto van de elektromechanische stimulatie platform en de user interface (computer). Klik hier voor een grotere versie van dit cijfer.
Zowel de stimulator en de methode voor elektromechanische conditioning zijn volledig beschreven in twee internationale patenten, WO-2013185818-A137 en38van de WO-2017125159-A1.
De biocompatibel siliconen constructies ontworpen om structurele steun geven aan cellen, elektroden, en magneten zijn geweest beschreven eerder10,21. Kortom, ze bestaan uit Polydimethylsiloxaan (PDMS), gegoten en genezen bij kamertemperatuur, met een Youngs modulus van 1.3 MPa, dicht bij de fysiologische niveaus. De constructie bevat een cel cultuur zwembad in een flexibele ruimte (10 x 10 x 2 mm), twee innerlijke transversale “slots” om te houden van de elektroden, en twee ingesloten 6 x 2 mm x 4 mm vernikkeld neodymium-magneten. De elektroden zijn gebouwd met 0,2 mm platina-draad twisted rond een 2 x 3 mm x 12 mm polytetrafluorethyleen (PTFE) kern bar (21 cm per elektrode, ongeveer 23 bochten) en aan weerszijden van de flexibele ruimte maken van een elektrisch veld voor inducerende geplaatst elektrische stimulatie. Mechanische uitrekken wordt bereikt door magnetische aantrekkingskracht tussen magneten ingebed in de steun en externe magneten geplaatst naast de cultuur-plaat en op de bewegende aluminium arm. Op deze manier, kan de cel ondersteuning worden uitgebreid zonder verbreking van de steriele barrière. Deze aanpak is geschikt voor een cel enkelgelaagde maar kon worden aangepast aan de driedimensionale constructies, ook.
Bovendien zou een regelmatig patroon ingeprinte waar de cellen worden overgeënt, met behulp van een gelinieerde diffractie raspen (1.250 groeven/mm). De directe visualisatie van de cellen gekweekt op het PDMS construct onder helderveld en fluorescente microscopen is mogelijk omwille van de transparantie en de 0.5 mm dikte. In het onderhavige geval heeft het PDMS cultuur zwembad een verticale oppervlaktepatroon, loodrecht op de uitrekkende force, de cellen loodrecht naar het elektrische veld, die het verloop van het elektrisch veld in de cel minimaliseert uitgelijnd.
Figuur 1 toont een detailbeschrijving van de constructie en het apparaat dat wordt gebruikt voor de stimulatie. De PDMS construeren en kenmerken zijn geoptimaliseerd voor mobiele rekken (figuur 1A, B). De stimulator is ontwikkeld en gevalideerd voor de effectieve toepassing van de gewenste elektrische en mechanische stimulatie naar cellen die zijn gekoppeld aan de PDMS construct. Dit proces omvat zorgen voor goede connectiviteit en gebruiker operability via de interface van de software (Figuur 1 c, D).
De procedure voor stimulatie van de cel met behulp van dit hulpmiddel naar maat wordt beschreven in de sectie protocol.
Protocol
Representative Results
Discussion
Elektromechanische stimulatie lijkt te zijn een veilig alternatief voor voorbereiden op een vijandige omgeving van de cardiale cellen en verbetering van hun cardiale inzet. Hier, een protocol beschreven voor cardiale voorlopercellen verhoogd de expressie van belangrijkste cardiale markers en was gemeld dat zij heilzaam zijn voor hun volgende implantatie op infarcted lymfkliertest myocard30. Electromechanically gestimuleerd cardiale ATDPCs verhoogd in het algemeen, de uitdrukking van de genen gerel…
Divulgations
The authors have nothing to disclose.
Acknowledgements
De auteurs willen de leden van de ICREC Research Program (IGTP, Badalona) en de elektronische instrumentatie groep Biomedische (UPC, Barcelona), met name Prof. J. Rosell-Ferrer bedanken. Bovendien, erkennen de auteurs stamcellen Translational Medicine journal en AlphaMed pers voor het toelaten van de aanpassing van de eerder gepubliceerde cijfers (Llucià-Valldeperas, et al.. 30). de ontwikkeling van dit prototype en het ontwerp van het protocol werden ondersteund door Ministerio de Educación y Ciencia (SAF 2008-05144), Ministerio de Economía y Competitividad (SAF 2014-59892), de EuropeseCommissie 7e kaderprogramma ( RECATABI, NMP3-SL-2009-229239), Fundació La Marató de TV3 (080330, 201516, 201502) en Fundación para la Innovación y la Prospectiva nl Salud nl España (FIPSE; 06-00001396-15).
Materials
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2X | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
References
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium’s electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology–Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).

