גירויים חשמליים ומכניים בו זמנית כדי לשפר את פוטנציאל Cardiomyogenic של תאים
Summary
כאן אנו מציגים פרוטוקול על הדרכת אוכלוסיה התא באמצעות גירויים חשמליים ומכניים הדמיית פיזיולוגיה של הלב. גירוי מכאני חשמלי זה משפר את הפוטנציאל cardiomyogenic של תאים שטופלו, אסטרטגיה מבטיח טיפול בתאי נוספת, מידול המחלה, והתרופות הקרנה.
Abstract
מחלות לב וכלי דם הן סיבת המוות המובילה במדינות המפותחות. כתוצאה מכך, הביקוש טיפולים יעילים תא לב יש מוטיבציה חוקרים תאי הגזע והשדות בביו-הנדסה לפיתוח במבחנה אמינות גבוהה האנושי שריר הלב מחקר בסיסי ויישומים קליניים. אולם, פנוטיפ ילדותי של תאי לב היא הגבלה על קבלת רקמות באופן פונקציונלי לחקות מבוגרים שריר הלב, אשר מאופיין בעיקר על ידי אותות מכניים וחשמליים. לכן, המטרה של פרוטוקול זה נועד להכין. ולומדים האוכלוסייה תא היעד באמצעות גירוי מכאני חשמלי, recapitulating פיסיולוגיים. הנדסת רקמות הלב הוא מתפתח לקראת גישות ביולוגיות יותר, אסטרטגיות המבוססת על גירויים biophysical, לפיכך, אתה צובר תאוצה. המכשיר שפותח למטרה זו הוא ייחודי ומאפשר בודדים או בו-זמניים חשמליים ומכניים גירוי, בזהירות מאופיין ואומתו. בנוסף, למרות המתודולוגיה מוטבה זה ממריץ, אוכלוסיה תא ספציפי, זה בקלות ניתן להתאים שורות תאים ומכשירים אחרים. התוצאות כאן מציעים ראיה המחויבות לב מוגברת של האוכלוסייה תא לאחר גירוי מכאני חשמלי. תאים electromechanically מגורה הצג ביטוי מוגבר של סמנים הלב הראשי, כולל גנים מוקדם מבניים, ויסות הסידן. מיזוג התא הזה עשוי להיות שימושי עבור טיפול בתאי משובי נוסף, מידול המחלה תפוקה גבוהה והתרופות הקרנה
Introduction
תפקוד הלב מבוסס על המושבים של עירור חשמלי והתכווצות מכני. בקצרה, צמתי המערכת cardiomyocyte היתר האות החשמלי הפצת לייצר כמעט סינכרונית התכווצויות הלב משאבת הדם מערכתית, דרך מערכת ריאתי. תאי לב, לפיכך, עוברים כוחות חשמליים ומכניים המסדירים ג’ין פונקציה ביטוי וסלולר. בהתאם לכך, קבוצות רבות ניסו לפתח תרבות פלטפורמות המחקים הסביבה פיזיולוגיים לב להבין את התפקיד של גירויים מכניים וחשמליים על התפתחות הלב, הפונקציה ההבשלה. במבחנה חשמליים ומכניים stimulations בנפרד הוחל בהרחבה בהנדסת רקמות הלב לשפר מאפיינים פונקציונליים, להגדיל את התא ההבשלה או לשפר את תא-תא צימוד וסידן טיפול1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. עם זאת, מיזוג אלקטרו-מכאניים סינכרונית נותר מנוצלת בגלל האתגר של פיתוח ממריץ, פרוטוקול, ובשל אופטימיזציה חובה22.
עבודה ראשוני התייחס גירוי מכאני חשמלי כשילוב של גירוי חשמלי זלוף מדיה; עם זאת, הזרם אינו כרוך להרכב מבוסס-זן טיפוסי של מילוי חדרית23,24,25. מאוחר יותר, יותר גישות פיזיולוגיים בשילוב גירויים חשמליים עם דפורמציה פיזי או מתיחה לחקות את isovolumetric התכווצות26,27,28,29,30 ,31. פנג et al. תיאר ההפגנה הראשונה של גירוי מכאני חשמלי בשנת 2005, דיווח משופרת cardiomyocyte גודל ומאפייני כויץ26. וואנג et al. pretreated גזע mesenchymal עם 5-azacytidine והחלת מיזוג חשמליים ומכניים בו זמנית, שיפור recellularization, תא הכדאיות, בידול הלב ואת רקמת שיפוץ27. מאז אותם פרסומים, יש קבוצות יותר דיווחו על גירוי מכאני חשמלי של תאים monolayers או מהונדסים רקמות (למשל, שחור28,29,Vunjak-Novakovic31, קבוצה30) עם תאים ממוזגים הראשון נבדק ויוו30. בקצרה, מורגן ושחור נבדק מספר שילובים של גירויים חשמליים ומכניים, דיווח כי התזמון בין stimulations היה מכריע משום שאיחרו גירוי מכאני חשמלי משולב הניבו את התוצאות הכי טוב28. בשלב הבא, Godier-Furnémont, משתפי פעולה ממוטב פרוטוקול גירוי מכאני חשמלי עבור בונה שריר הלב מהונדסים מתאי הלב עכברוש neonatal, מושגת, בפעם הראשונה, מערכת יחסים של כוח חיובי-תדירות29. לאחר מכן, הקבוצה שלנו דיווחו כי תאי electromechanically preconditioned גדלו הביטוי של סמנים הלב הראשי במבחנה רחבה מועיל אפקטים ויוו, כגון שיפור תפקוד הלב או גדלה צפיפות כלי ב- לאוטם אזור הגבול30. הפרסום האחרון הוכיח כי רקמות הלב מן גזע-תא-derived cardiomyocytes נתון מיזוג אלקטרו-מכאניים הגיעו עם ההבשלה ברמה קרובה להיות אנושית למבוגרים לב מבנה ותפקוד31. בנוסף, פלטפורמות חלופיות גירוי תלת מימדי מהווים פיגומים electroactive המספקים חשמלי, מכני, ומצורפת רמזים הטופוגרפי לתאי32. יתר על כן, דפורמציה מכאנית (תא טפט מתיחה ודחיסה) יכולה להיגרם גם עם אלקטרודות מתיחה מחקה נורמלי בתנאים פיזיולוגיים, כמו גם בתנאים קיצוניים33.
לכן, הרציונל הוא הפריה גירויים אלקטרו-מכאניים בהתבסס על תנאים פיזיולוגיים יכול לשפר את הפוטנציאל cardiomyogenic של תא. אכן, לגירוי הזה יכול להפיק תועלת נוספת שילובים של תאים טיפולית לתוך שריר הלב בתרחיש קליני או להגדיל את רקמת ההבשלה ליישומים סמים-הקרנה.
בנוסף, אנו מבודדים, מאופיין אוכלוסיה של האדם נגזר רקמת שומן ובתאים של הלב מוצא (ATDPCs לב)34. תאים אלה נמצאים השומן epicardial. תאים אלה להציג השפעות מועילות histopathological ופונקציונליים בטיפול של אוטם שריר הלב, גם לתחזק את הלב ואת אנדותל בידול פוטנציאליים. 30 , 35. שיערנו כי יתרונות אלו יגדל לאחר גירוי ביופיזיקלי.
כתוצאה מכך, אנו פיתחה מכשיר משטר גירוי עבור האוכלוסייה תא עניין, חקר את ההשפעות. פרוטוקול זה אלקטרו-מכאניים אסטרטגיה חדשה לזירוז התא הפעיל מתיחה באופן סטרילי, noninvasively לעומת הקודם פרסומים36, בשילוב עם גירוי שדה חשמלי. הטכניקה דיווחו כאן מסביר בפירוט את ההתקן ואת שיטת המשמש את גירוי חשמלי, מכני, אלקטרו-מכאניים של תאים.
מכשיר זה יכול לספק גירויים חשמליים ומכניים, באופן עצמאי או בעת ובעונה אחת. הגירוי מתבצע עם גישה מוזרה אספטי לא פולשנית, הכולל תמיכה תא presterilized, אלקטרודות בתוך צלחת רגילה תרבות, ובעל פלטפורמה המשרה כלפי כוחות מכניים וחשמליים (איור 1).
הפלטפורמה יכולה להכיל עד 6 צלחות ותרבות מורכב מבנה כריך של לייזר poly(methyl methacrylate) וחתיכות המעגלים המודפסים. האבטיפוס פלטפורמה מתבסס על שילוב של monophasic לתכנות מבוקר-מחשב חשמל ממריץ, לוח מעגלים מודפסים עבור החיבור חזקים של אלקטרודות, ו 6 10 מ מ x 10 מ מ x 5 מ מ מ נאודימיום-קבוע מגנטים הניח ליד צד אחד של הלוחות תרבות. במלון יש גם בר אלומיניום עם שישה נהיגה מגנטים (לדוגמא) הניח לפני הצד השני של הלוחות תרבות ועבר עם במנוע סרוו ליניארי. המנוע הוא מונע על ידי בקר מנוע, המופעל באמצעות יציאת RS-232 על ידי תוכנה מסחרית (ראה את הטבלה של חומרים). דרך ממשק המשתמש ממריץ לתכנות, זה ניתן לתכנת את עוצמת חשמל, המשך את הדופק, תדר, התדירות של גירוי מכני, מחזור חיים שלה, מספר פולסים, הדופק משרעת (טיול מגנט), המדרון.
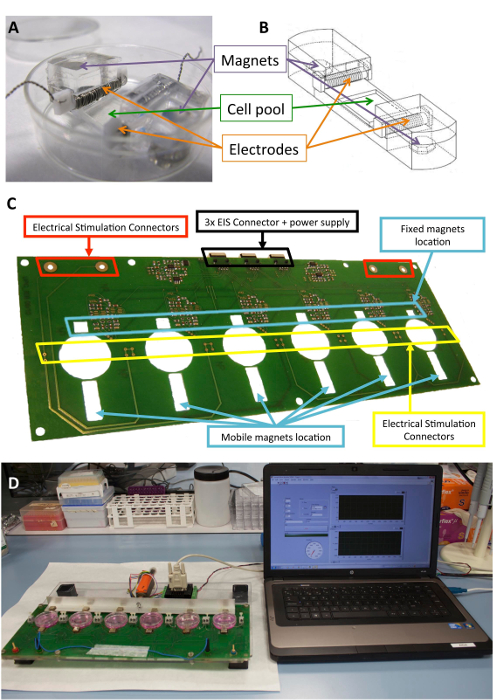
איור 1 : ממריץ אלקטרו- (א) PDMS המבנה המשמש את מיזוג התא. (B) ציור של הבונה PDMS, כולל אלקטרודות ומגנטים. (ג) פירוט של הלוח מעגל מודפס (פלטפורמה) המשמש לביצוע ההתניה אלקטרו-מכאניים. לוח זה שונה מ- Llucià-Valldeperas et al.30. (ד) תמונה של גירוי מכאני חשמלי פלטפורמה וממשק משתמש (מחשב). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
ממריץ את וגם את שיטת אלקטרו-מכאניים מיזוג מלא מתוארים שני הפטנטים הבינלאומי, וו-2013185818-A137 ו וו-2017125159-A138.
שהסיליקון מסתיימים מבנים שנועדו לספק תמיכה מבנית לתאים, אלקטרודות של מגנטים כבר שתוארה קודם לכן10,21. בקצרה, הם מורכבים של polydimethylsiloxane (PDMS), יצוק ולרפא בטמפרטורת החדר, עם מודול האלסטיות של MPa 1.3, קרוב רמות פיזיולוגיים. הבונה מכיל בריכה התרבות תאים באזור גמיש (10 מ מ x 10 מ”מ x 2 מ”מ), שני חריצים רוחביים הפנימי להחזיק את האלקטרודות, ושניים משובצים 6 מ”מ x 2 מ”מ x 4 מ מ ממ נאודימיום מגנטים. האלקטרודות בנויים על 0.2 מ מ פלטינום תיל כרוכים סביב 2 מ”מ x 3 מ”מ x מ מ 12 טפלון (PTFE) core בר (21 ס מ לכל אלקטרודה, פונה כ 23) והניח בשני צידי אזור גמיש כדי ליצור שדה חשמלי להשראת גירוי חשמלי. מתיחה מכנית מושגת באמצעות משיכה מגנטי בין מגנטים נעוץ התמיכה מגנטים חיצוני להציב ליד הלוחית תרבות, על זרוע אלומיניום נע. בדרך זו, ניתן להרחיב את התמיכה התא מבלי לשבור את מחסום סטרילי. גישה זו מתאימה טפט תא אבל יכול להיות מותאם מבנים תלת-ממדי, כמו גם.
בנוסף, דפוס קבוע יכול להיות מוטבעים בו התאים אינם נזרע, שימוש סריג עקיפה הנשלטים (1,250 חריצים מ”מ). פריט חזותי ישיר של תאים תרבותי על הבונה PDMS תחת brightfield ומיקרוסקופים פלורסנט אפשרי בשל שקיפות 0.5 מ מ עובי. במקרה הנוכחי, בבריכה תרבות PDMS יש דפוס פני שטח אנכי, אנכי כוח מתיחה, כדי ליישר את התאים בניצב לשדה חשמלי, אשר מצמצם את המילוי ההדרגתי של שדה חשמלי על פני התא.
איור 1 מציג תיאור מפורט של מבנה, מכשיר המשמש את הגירוי. PDMS לבנות, מאפיינים ממוטבים עבור תא מתיחה (איור 1 א’, ב’). ממריץ הוא פיתח ואומת עבור יישום אפקטיבי של הגירוי הרצוי חשמליים ומכניים לתאים המחוברים הבונה PDMS. תהליך זה כולל הקפדה טובה operability בקישוריות המשתמש באמצעות ממשק תוכנה (איור 1C, יח).
ההליך עבור תא גירוי באמצעות התקן בהזמנה אישית זה מתוארת בסעיף פרוטוקול.
Protocol
Representative Results
Discussion
גירוי מכאני חשמלי שנראה חלופה בטוחה עבור הכנת תאי הלב סביבה עוינת ושיפור מחויבותם הלב. . הנה, פרוטוקול המתואר ובתאים לב מוגברת הביטוי של סמנים הלב הראשי, היה דיווח להיות מועיל עבור שלהם השרשה הבא על שריר הלב מאתר infarcted30. באופן כללי, ATDPCs לב electromechanically מגורה עלה הביטוי של גנים הקשו…
Divulgations
The authors have nothing to disclose.
Acknowledgements
המחברים רוצה להודות חברי תכנית המחקר של ICREC (IGTP, בדלונה) ואת אלקטרונית קבוצה במכשור ביו-רפואי (UPC, ברצלונה), במיוחד פרופסור ג’יי Rosell-פרר. בנוסף, המחברים להכיר תאי גזע Translational רפואה יומן ולחץ AlphaMed עבור המתיר את העיבוד של דמויות שפורסמו בעבר (Llucià-Valldeperas, et al. 30)-הפיתוח של האב-טיפוס הזה, העיצוב של הפרוטוקול נתמכו Ministerio דה Educación y Ciencia (SAF 2008-05144), Ministerio דה Economía y Competitividad (SAF 2014-59892), הנציבות האירופית (תכנית המסגרת השביעית RECATABI, NMP3-SL-2009-229239), פונדציו La Marató de TV3 (080330, 201516, 201502), Fundación פארא לה Innovación y la Prospectiva en סאלוד en אספניה (FIPSE; 00001396-06-15).
Materials
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2X | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4′,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
References
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium’s electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology–Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).

