Caracterização das Propriedades de Transporte Intra-Cartilagem dos Transportadores de Peptídeos Cationic
Summary
Este protocolo determina a absorção de equilíbrio, profundidade de penetração e taxa de difusão de não-equilíbrio para portadores de peptídeos cationicos na cartilagem. A caracterização das propriedades de transporte é fundamental para garantir uma resposta biológica eficaz. Esses métodos podem ser aplicados para projetar um portador de drogas com carga ideal para direcionar tecidos carregados negativamente.
Abstract
Vários tecidos carregados negativamente no corpo, como a cartilagem, apresentam uma barreira para o fornecimento de medicamentos direcionados devido à sua alta densidade de aggrecans carregados negativamente e, portanto, requerem métodos de mira melhorados para aumentar sua resposta terapêutica. Como a cartilagem tem uma alta densidade de carga fixa negativa, as drogas podem ser modificadas com portadores de drogas positivamente carregados para tirar proveito das interações eletrostáticas, permitindo um maior transporte de drogas intra-cartilagem. Estudar o transporte de transportadores de drogas é, portanto, crucial para prever a eficácia dos medicamentos na indução de uma resposta biológica. Mostramos o desenho de três experimentos que podem quantificar a absorção de equilíbrio, profundidade de penetração e taxa de difusão não-equilíbrio de portadores de peptídeos cationicos em explantas de cartilagem. Os experimentos de absorção de equilíbrio fornecem uma medida da concentração de soluto dentro da cartilagem em comparação com seu banho circundante, o que é útil para prever o potencial de um portador de drogas no aumento da concentração terapêutica de drogas na cartilagem. Estudos de profundidade de penetração utilizando microscopia confocal permitem a representação visual da difusão soluto 1D da zona superficial para profunda da cartilagem, o que é importante para avaliar se os solutos atingem seus locais de destino matriz e celular. Estudos de taxa de difusão não-equilíbrio utilizando uma câmara de transporte personalizada permitem medir a força das interações de ligação com a matriz tecidual caracterizando as taxas de difusão de solutos fluorescentes rotulados através do tecido; isso é benéfico para projetar portadores de força de ligação ideal com cartilagem. Juntos, os resultados obtidos a partir dos três experimentos de transporte fornecem uma diretriz para projetar portadores de medicamentos com carga ideal que se aproveitam de interações de carga fracas e reversíveis para aplicações de entrega de medicamentos. Estes métodos experimentais também podem ser aplicados para avaliar o transporte de drogas e conjugados portadores de drogas. Além disso, esses métodos podem ser adaptados para uso na segmentação de outros tecidos carregados negativamente, como menisco, córnea e humor vítreo.
Introduction
A entrega de drogas para tecidos carregados negativamente no corpo continua sendo um desafio devido à incapacidade de as drogas penetrarem profundamente no tecido para alcançar os locais-alvo das células e matrizes1. Vários desses tecidos são compostos por aggrecans densamente embalados e carregados negativamente que criam uma alta densidade de carga fixa negativa (FCD)2 dentro do tecido e agem como uma barreira para a entrega da maioria das macromoléculas3,,4. No entanto, com a ajuda de portadores de medicamentos carregados positivamente, essa barreira tecidual carregada negativamente pode ser convertida em um depósito de drogas através de interações de carga eletrostática para entrega sustentada de medicamentos1,,5,,6,7(Figura 1).
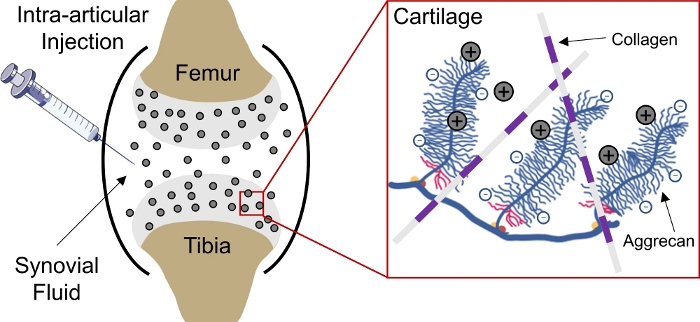
Figura 1: Entrega intra cartilagem baseada em carga de CPCs. Injeção intra-articular de CPCs no espaço articular do joelho. Interações eletrostáticas entre CPCs carregados positivamente e grupos aggrecanos carregados negativamente permitem penetração rápida e completa de profundidade através da cartilagem. Este número foi modificado de Vedadghavami et al4. Clique aqui para ver uma versão maior desta figura.
Recentemente, os portadores de peptídeos cáticos de curto comprimento (CPCs) foram projetados com o objetivo de criar pequenos domínios cônicos capazes de realizar terapêuticas de tamanho maior para entrega à cartilagem4carregada negativamente . Para o fornecimento eficaz de medicamentos à cartilagem para o tratamento de doenças prevalentes8,,9 e degenerativas como a osteoartrite (OA)10, é fundamental que as concentrações terapêuticas de drogas penetrem profundamente dentro do tecido, onde a maioria das células de cartilagem (condrócitos)residem 11. Embora existam vários medicamentos potenciais modificados por doenças disponíveis, nenhum deles obteve a aprovação da FDA porque estes são incapazes de atingir efetivamente a cartilagem12,13. Portanto, a avaliação das propriedades de transporte dos transportadores de drogas é necessária para prever a eficácia dos medicamentos na indução de uma resposta terapêutica. Aqui, projetamos três experimentos separados que podem ser utilizados para avaliar a captação de equilíbrio, profundidade de penetração e taxa de difusão não-equilíbrio dos CPCs4.
Para garantir que haja uma concentração suficiente de medicamentos dentro da cartilagem que possa fornecer uma resposta terapêutica ideal, os experimentos de absorção foram projetados para quantificar a concentração de CPC de equilíbrio na cartilagem4. Neste desenho, seguindo um equilíbrio entre a cartilagem e seu banho circundante, a quantidade total de soluto dentro da cartilagem (vinculada à matriz ou livre) pode ser determinada usando uma razão de absorção. Essa razão é calculada pela normalização da concentração de solutos dentro da cartilagem ao do banho de equilíbrio. Em princípio, solutos neutros, cuja difusão através da cartilagem não é assistida por interações de carga, teriam uma razão de absorção inferior a 1. Por outro lado, solutos cáticos, cujo transporte é aprimorado através de interações eletrostáticas, mostram uma razão de absorção maior que 1. No entanto, como mostrado com os CPCs, o uso de uma carga positiva ideal pode resultar em taxas de absorção muito maiores (superiores a 300)4.
Embora a alta concentração de medicamentos dentro da cartilagem seja importante para alcançar o benefício terapêutico, também é fundamental que as drogas difundam através da espessura total da cartilagem. Portanto, estudos mostrando a profundidade da penetração são necessários para garantir que os medicamentos cheguem fundo dentro da cartilagem para que os locais de matriz e destino celular possam ser alcançados, proporcionando assim uma terapia mais eficaz. Este experimento foi projetado para avaliar a difusão unidirecional de solutos através da cartilagem, simulando a difusão de drogas em cartilagem após injeção intra-articular in vivo. A imagem de fluorescência usando microscopia confocal permite a avaliação da profundidade de penetração na cartilagem. A carga de partículas líquidas desempenha um papel fundamental na moderação de como drogas profundas podem difundir através da matriz. Uma carga líquida ideal baseada em um tecido FCD é necessária para permitir interações de ligação fraca-reversíveis entre partículas cônicas e a matriz tecidual. Isso implica que qualquer interação é fraca o suficiente para que as partículas possam se desassociar da matriz, mas reversível na natureza para que possa se ligar a outro local de ligação de matriz mais profunda dentro do tecido4. Por outro lado, a carga líquida positiva excessiva de uma partícula pode ser prejudicial para a difusão, uma vez que a ligação matricial muito forte impede o descolamento de partículas do local de ligação inicial na zona superficial da cartilagem. Isso resultaria em uma resposta biológica insuficiente, pois a maioria dos locais alvos está profundamente dentro do tecido11.
Para quantificar ainda mais a força das interações de ligação, a análise das taxas de difusão de medicamentos através da cartilagem é vantajosa. Estudos de difusão de não equilíbrio permitem a comparação das taxas de difusão em tempo real entre diferentes solutos. À medida que as drogas se difundem através das zonas superficiais, médias e profundas da cartilagem, a presença de interações de ligação pode alterar muito as taxas de difusão. Quando as interações de ligação estão presentes entre as drogas e a matriz da cartilagem, ela é definida como a difusividade efetiva(D EFF). Neste caso, uma vez ocupados todos os locais vinculantes, a taxa de difusão de medicamentos é regida pela difusão de estado estável(SS). A comparação entre oEFF D de solute diferente determina a força relativa de ligação dos solutos com a matriz. Para um determinado soluto, se o DEFF e dSS estão dentro da mesma ordem de magnitude, implica que há uma ligação mínima presente entre a droga e a matriz durante a difusão. No entanto, seo D EFF for maior que o DSS,existe uma ligação substancial de partículas à matriz.
Os experimentos projetados individualmente permitem a caracterização do transporte soluto através da cartilagem, no entanto, uma análise holística inclusiva de todos os resultados é necessária para projetar um portador de medicamentos com carga ideal. A natureza fraca e reversível das interações de carga controla a taxa de difusão de partículas e permite uma alta absorção de equilíbrio e rápida penetração de profundidade total através da cartilagem. Através de experimentos de captação de equilíbrio, devemos procurar portadores que apresentem alta absorção como resultado de interações de carga que podem ser verificadas por meio de estudos de taxa de difusão de não equilíbrio. No entanto, essas interações de ligação devem ser fracas e reversíveis na natureza para permitir a penetração da espessura total do soluto através da cartilagem. Um portador de drogas ideal possui uma carga ideal que permite uma ligação forte o suficiente para absorção e altas concentrações de drogas intra-cartilagem, mas não muito forte a ponto de impedir a difusão de espessura total4. Os experimentos apresentados auxiliarão nas características de design para os portadores de medicamentos baseados em carga. Esses protocolos foram utilizados para caracterizar o transporte de CPC através da cartilagem4,porém, estes também podem ser aplicados a uma variedade de medicamentos e portadores de drogas através de cartilagem e outros tecidos carregados negativamente.
Protocol
Representative Results
Discussion
Os métodos e protocolos descritos aqui são significativos para o campo da entrega de medicamentos direcionados para tecidos carregados negativamente. Devido à alta densidade de aggrecans carregados negativamente presentes nesses tecidos, cria-se uma barreira, impedindo assim que as drogas atinjam seus locais de destino celular que estão no fundo da matriz. Para enfrentar este desafio pendente, os medicamentos podem ser modificados para incorporar portadores de medicamentos carregados positivamente que podem aumentar …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi financiado pelo Departamento de Defesa dos Estados Unidos através dos Programas de Pesquisa Médica Dirigidos pelo Congresso (CDMRP) sob o contrato W81XWH-17-1-0085, e o Instituto Nacional de Saúde R03 EB025903-1. A AV foi financiada pela Faculdade de Engenharia da Universidade do Nordeste.
Materials
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18×18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7×2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
References
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis – An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta – Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).

