Katyonik Peptit Taşıyıcılarının Kıkırdak İçi Taşıma Özelliklerinin Karakterizasyonu
Summary
Bu protokol kıkırdakta katyonik peptid taşıyıcıları için denge alımını, penetrasyon derinliğini ve non-denge difüzyon oranını belirler. Taşıma özelliklerinin karakterizasyonu etkili bir biyolojik yanıt sağlamak için çok önemlidir. Bu yöntemler, negatif yüklü dokuları hedeflemek için en uygun ücrete uygun bir uyuşturucu taşıyıcısı tasarlamak için uygulanabilir.
Abstract
Vücuttaki kıkırdak gibi çeşitli negatif yüklü dokular, negatif yüklü aggrecans yüksek yoğunluklu nedeniyle hedeflenen ilaç teslim için bir bariyer mevcut ve bu nedenle, onların terapötik tepkiyi artırmak için geliştirilmiş hedefleme yöntemleri gerektirir. Kıkırdak yüksek negatif sabit yük yoğunluğuna sahip olduğundan, ilaçlar elektrostatik etkileşimlerden yararlanmak için pozitif yüklü ilaç taşıyıcıları ile değiştirilebilir, gelişmiş intra-kıkırdak ilaç taşıma için izin. Bu nedenle, uyuşturucu taşıyıcılarının taşınmasının incelenmesi, biyolojik bir tepkinin neden olduğu ilaçların etkinliğini tahmin etme de son derece önemlidir. Kıkırdak ekspertizlerinde katyonik peptid taşıyıcılarının denge alımını, penetrasyon derinliğini ve denge selektifüzyon hızını ölçebilen üç deney tasarımını gösteriyoruz. Denge alım deneyleri, kıkırdaktaki ilaçların terapötik konsantrasyonunu artırmada bir ilaç taşıyıcısının potansiyelini tahmin etmek için yararlı olan, çevredeki banyoya kıyasla, kıkırdak içindeki çözünür konsantrasyonunun bir ölçüsünü sağlar. Konfokal mikroskopi ile yapılan penetrasyon çalışmalarının derinliği, 1D çözünür difüzyonun yüzeyselden kıkırdağın derin bölgesine kadar görsel olarak temsil edilmesine olanak sağlar, bu da solutelerin matris ve hücresel hedef bölgelerine ulaşıp ulaşmadığını değerlendirmek için önemlidir. Özel olarak tasarlanmış bir taşıma odası kullanılarak yapılan denge dışı difüzyon oranı çalışmaları, floresan olarak etiketlenmiş solutelerin doku boyunca difüzyon oranlarını karakterize ederek doku matrisi ile bağlayıcı etkileşimlerin gücünün ölçülmesini sağlar; bu kıkırdak ile optimum bağlama gücü taşıyıcıları tasarımı için yararlıdır. Birlikte, üç taşıma deneylerinden elde edilen sonuçlar, ilaç dağıtım uygulamaları için zayıf ve geri döndürülebilir şarj etkileşimlerinden yararlanan en iyi şekilde şarj edilen uyuşturucu taşıyıcılarının tasarlanması için bir kılavuz sağlamaktadır. Bu deneysel yöntemler, uyuşturucu ve uyuşturucu taşıyıcı konjugatlarının taşınmasını değerlendirmek için de uygulanabilir. Ayrıca, bu yöntemler menisküs, kornea ve vitreus mizah gibi diğer negatif yüklü dokuların hedef alınmasında kullanım için uyarlanabilir.
Introduction
Vücutta negatif yüklü dokulara ilaç teslimi hücre ve matris hedef sitelere ulaşmak için doku içine nüfuz etmek için ilaçların yetersizlik nedeniyle bir sorun olmaya devam etmektedir1. Bu dokuların bazıları doku içinde yüksek negatif sabit yük yoğunluğu (FCD)2 oluşturmak ve enmakromoleküllerinteslimi için bir engel olarak hareket yoğun paketlenmiş, negatif yüklü agrecans oluşur 3,4. Ancak, pozitif yüklü ilaç taşıyıcılarının yardımıyla, bu negatif yüklü doku bariyeri aslında sürekli ilaçteslimi 1,5,,6,7(Şekil 1)için elektrostatik yük etkileşimleri yoluyla bir ilaç deposuna dönüştürülebilir.
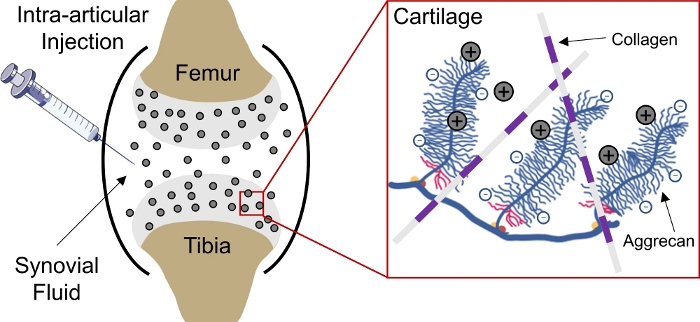
Şekil 1: CpC’lerin şarj bazlı kıkırdak içi teslimi. Diz eklemi alanına Eklem içi enjeksiyon. Pozitif yüklü TBM’ler ile negatif yüklü agrega grupları arasındaki elektrostatik etkileşimler kıkırdak yoluyla hızlı ve tam derinlikte penetrasyon sağlar. Bu rakam Vedadghavami ve ark4değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Son zamanlarda, kısa uzunlukta katyonik peptid taşıyıcıları (CpCs) negatif yüklü kıkırdak teslim için büyük boyutlu terapötik taşıma kapasitesine sahip küçük katyonik etki alanları oluşturma amacı ile tasarlanmıştır4. Yaygın8,,9 ve osteoartrit gibi dejeneratif hastalıkların tedavisi için kıkırdak etkili ilaç teslimi için (OA)10, bu ilaçların terapötik konsantrasyonları doku içinde derin nüfuz kritiktir, kıkırdak hücrelerinin çoğunluğu (konkolitler) yalan11. Mevcut çeşitli potansiyel hastalık modifiye ilaçlar olmasına rağmen, bu etkili kıkırdak 12 ,,13hedef mümkün değildir, çünkü hiçbiri FDA onayı kazanmıştır.12 Bu nedenle, terapötik yanıt ın indüklemede ilaçların etkinliğini tahmin etmek için uyuşturucu taşıyıcılarının taşıma özelliklerinin değerlendirilmesi gereklidir. Burada, denge alımını, penetrasyon derinliğini ve CpCs4’ündenge dışı difüzyon oranını değerlendirmek için kullanılabilen üç ayrı deney tasarladık.
En iyi terapötik yanıt sağlayabilir kıkırdak içinde yeterli bir ilaç konsantrasyonu olduğundan emin olmak için, uptake deneyler kıkırdak denge CPC konsantrasyonu ölçmek için tasarlanmıştır4. Bu tasarımda, kıkırdak ve çevresindeki banyo arasındaki dengeyi takiben, kıkırdak içindeki toplam solute miktarı (matrise bağlı veya serbest) alım oranı kullanılarak belirlenebilir. Bu oran, kıkırdak içindeki solutelerin konsantrasyonunun denge banyosuna normalleştirilmesi yle hesaplanır. Prensip olarak, kıkırdak yoluyla difüzyon şarj etkileşimleri ile desteklenmez nötr solutes, daha az bir alım oranı olurdu 1. Tersine, taşınması elektrostatik etkileşimler yoluyla geliştirilmiş katyonik solutes, 1’den büyük bir alım oranı gösterir. Ancak, TBM’lerde gösterildiği gibi, optimal pozitif yük kullanımı çok daha yüksek alım oranlarına (300’den büyük)4neden olabilir.
Kıkırdak içinde yüksek ilaç konsantrasyonu terapötik yarar elde etmek için önemli olmasına rağmen, aynı zamanda ilaçların kıkırdak tam kalınlığı ile yayılır önemlidir. Bu nedenle, penetrasyon derinliğini gösteren çalışmalar, ilaçların kıkırdak içinde derinlere ulaşmasını sağlamak için gerekli olup, böylece matris ve hücresel hedef bölgelere ulaşılabilmekte ve böylece daha etkili bir tedavi sağlanmaktadır. Bu deney, solutelerin kıkırdak yoluyla tek yönlü difüzyonu değerlendirmek ve in vivo intra-artiküler enjeksiyonsonrasında kıkırdak içine ilaç difüzyonu simüle etmek için tasarlanmıştır. Konfokal mikroskopi ile floresan görüntüleme kıkırdak içine penetrasyon derinliği nin değerlendirilmesi için izin verir. Net parçacık yükü, derin ilaçların matris boyunca nasıl yayılabilir moderating önemli bir rol oynar. Katyonik parçacıklar ve anyonik doku matrisi arasındaki zayıf-geri dönüşümlü bağlanma etkileşimlerine izin vermek için fcd dokusuna dayalı optimal bir net yük gereklidir. Bu, herhangi bir etkileşimin parçacıkların matristen kopabilmesi için yeterince zayıf olduğu anlamına gelir, ancak doğada geri döndürülebilir, böylece doku içinde daha derin bir matris bağlama bölgesine bağlanabilir4. Tersine, çok güçlü matris bağlama kıkırdağın yüzeysel bölgesinde ilk bağlama sitesinden parçacıkların ayrılmasını önler gibi, bir parçacığın aşırı pozitif net yük difüzyon doğru zararlı olabilir. Bu hedef sitelerin çoğunluğu doku11içinde derin yalan olarak yetersiz bir biyolojik yanıt neden olur.
Bağlayıcı etkileşimlerin gücünü daha fazla ölçmek için, kıkırdak yoluyla ilaç difüzyon oranlarının analizi avantajlıdır. Non-denge difüzyon çalışmaları farklı solutes arasında gerçek zamanlı difüzyon oranlarının karşılaştırılması için izin verir. İlaçlar kıkırdağın yüzeysel, orta ve derin bölgelerinden yayıldıkça, bağlayıcı etkileşimlerin varlığı difüzyon oranlarını büyük ölçüde değiştirebilir. İlaçlar ve kıkırdak matrisi arasında bağlayıcı etkileşimler mevcut olduğunda, etkili difüzivite (DEFF)olarak tanımlanır. Bu durumda, tüm bağlayıcı bölgeler işgal edildikten sonra, ilaçların difüzyon oranı sabit durum difüzyonu (DSS)tarafından yönetilir. Farklı solute DEFF arasındaki karşılaştırma matris ile solutes göreli bağlama mukavemeti belirler. Belirli bir çözüniçin, DEFF ve DSS büyüklük aynı sırada ise, bu difüzyon sırasında ilaç ve matris arasında minimal bağlayıcı mevcut olduğunu ima eder. Ancak, DEFF DSS’denbüyükse, parçacıkların matrislere önemli ölçüde bağlanması vardır.
Tasarlanan deneyler ayrı ayrı kıkırdak yoluyla çözünür taşıma karakterizasyonu için izin, ancak, tüm sonuçları kapsayıcı bütünsel bir analiz en iyi ücret uyuşturucu taşıyıcı tasarımı için gereklidir. Şarj etkileşimlerinin zayıf ve geri dönüşümlü doğası parçacık difüzyon hızını kontrol eder ve kıkırdak yoluyla yüksek denge alımı ve hızlı tam derinlik penetrasyonu sağlar. Denge alım deneyleri ile, non-denge difüzyon hızı çalışmaları kullanılarak doğrulanabilir şarj etkileşimleri sonucunda yüksek alım gösteren taşıyıcılar aramak gerekir. Ancak, bu bağlayıcı etkileşimler kıkırdak yoluyla çözünür tam kalınlıkta penetrasyon sağlamak için doğada zayıf ve geri dönüşümlü olmalıdır. İdeal bir ilaç taşıyıcı alımı ve yüksek intra-kıkırdak ilaç konsantrasyonları için yeterince güçlü bağlayıcı sağlayan optimal bir şarj sahip olacak, ama tam kalınlıkta difüzyon engel olarak çok güçlü değil4. Sunulan deneyler, ilaç taşıyıcılarını hedef alan şarj tabanlı dokuların tasarım özelliklerine yardımcı olacaktır. Bu protokoller kıkırdak4ile TBM taşımacılığı karakterize için kullanılmıştır, Ancak, bu da kıkırdak ve diğer negatif yüklü dokular yoluyla ilaç ve ilaç taşıyıcıları çeşitli uygulanabilir.
Protocol
Representative Results
Discussion
Burada açıklanan yöntem ve protokoller, negatif yüklü dokulara hedeflenen ilaç teslimatı alanında önemli. Bu dokularda bulunan negatif yüklü aggrecanların yoğunluğunun yüksek olması nedeniyle, bir bariyer oluşturularak ilaçların matrisin derinliklerinde bulunan hücresel hedef bölgelerine ulaşmasını engeller. Bu olağanüstü sorunu gidermek için, ilaçlar taşıma oranını artırabilir pozitif yüklü ilaç taşıyıcıları dahil etmek için değiştirilebilir, alım ve doku içinde ilaçların…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, W81XWH-17-1-0085 sözleşmesi kapsamında Kongre Tarafından Yönlendirilmiş Tıbbi Araştırma Programları (CDMRP) ve Ulusal Sağlık Enstitüsü R03 EB025903-1 aracılığıyla Amerika Birleşik Devletleri Savunma Bakanlığı tarafından finanse edilmiştir. AV, Northeastern Üniversitesi Mühendislik Fakültesi Dekan Bursu tarafından finanse edilmiştir.
Materials
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18×18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7×2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
References
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis – An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta – Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).

