Analisi e specificazione delle distribuzioni delle dimensioni dei granuli di amido
Summary
Qui è presentata una procedura per determinare in modo riproducibile e statisticamente valido le distribuzioni delle dimensioni dei granuli di amido e per specificare le distribuzioni di dimensioni lognormali del granulo determinate utilizzando una forma moltiplicativa a due parametri. È applicabile a tutte le analisi di dimensionamento dei granuli di campioni di amido su scala grammo per la ricerca sulle piante e sulle scienze alimentari.
Abstract
L’amido proveniente da tutte le fonti vegetali è costituito da granuli in una gamma di dimensioni e forme con frequenze di occorrenza diverse, cioè che presentano una dimensione e una distribuzione dellaforma. I dati sulle dimensioni dei granuli di amido determinati utilizzando diversi tipi di tecniche di dimensionamento delle particelle sono spesso problematici a causa della scarsa riproducibilità o mancanza di significatività statistica derivante da alcuni errori sistematici insormontabili, tra cui la sensibilità alle forme dei granuli e i limiti delle dimensioni del campione di granuli. Abbiamo delineato una procedura per determinare in modo riproducibile e statisticamente valido le distribuzioni delle dimensioni dei granuli di amido utilizzando la tecnica della zona di rilevamento elettrico e per specificare le distribuzioni di dimensioni lognormali del granulo determinate utilizzando una forma moltiplicativa a due parametri adottata con una maggiore precisione e comparabilità. È applicabile a tutte le analisi di dimensionamento dei granuli di campioni di amido su scala grammo e, pertanto, potrebbe facilitare gli studi su come le dimensioni dei granuli di amido sono modellate dall’apparato e dai meccanismi di biosintesi dell’amido; e come hanno un impatto sulle proprietà e sulla funzionalità degli amidi per usi alimentari e industriali. I risultati rappresentativi sono presentati da analisi replicate delle distribuzioni delle dimensioni dei granuli di campioni di amido di sweetpotato utilizzando la procedura delineata. Abbiamo inoltre discusso diversi aspetti tecnici chiave della procedura, in particolare la specifica moltiplicativa delle distribuzioni di dimensioni lognormali del granulo e alcuni mezzi tecnici per superare il blocco frequente dell’apertura da parte degli aggregati di granuli.
Introduction
I granuli di amido sono la struttura fisica in cui due principali polimeri omoglucani di riserva nei tessuti di fotosintesi e stoccaggio delle piante, l’amilosio lineare o scarsamente ramificata e l’amiloetina altamente ramificata, sono imballati in modo ordinato insieme ad alcuni componenti minori, inclusi lipidi e proteine. I granuli di amido di varie specie vegetali presentano molte forme tridimensionali (3D) (riviste nel ref.1,2), tra cui sfere, ellissoidi, poliedri, piastrine, cubi, cuboidi e tubuli irregolari. Anche quelli dello stesso tessuto o tessuti diversi della stessa specie vegetale potrebbero avere un insieme di forme con frequenze di occorrenza variabili. In altre parole, i granuli di amido di una specie vegetale possono avere una distribuzione statistica caratteristica della forma, piuttosto che una forma specifica. Le forme granuli non uniformi e non sferiche rendono difficile misurare e definire correttamente le dimensioni dei granuli di amido. Inoltre, i granuli di amido degli stessi tessuti di una specie vegetale sono di una gamma di dimensioni con proporzioni diverse, cioè presentano una distribuzione caratteristica delle dimensioni. Questa distribuzione delle dimensioni complica ulteriormente l’analisi e la descrizione delle dimensioni dei granuli di amido.
Le dimensioni dei granuli di amido sono state analizzate utilizzando diverse categorie di tecniche di dimensionamento delle particelle (esaminate nella rif. 3 ), tra cui microscopia, sedimentazione/frazionamento sterico campo-flusso (Sd/StFFF), diffrazione laser e zona dirilevamentoelettrico (ESZ). Tuttavia, queste tecniche non sono ugualmente adatte per la determinazione delle dimensioni dei granuli di amido in presenza di una forma di granulo e di una distribuzione delle dimensioni. La microscopia, compresa la microscopia elettronica leggera, confocale e a scansione, è eccellente per gli studidi morfologia 4,5,6,7,struttura8,9 e sviluppo10,11 di granuli di amido, ma difficilmente adatta a definire le loro distribuzioni di dimensioni a causa di alcune carenze intrinseche. Misurazioni dirette di immagini microscopiche di granuli o analisi di immagini assistite da software di dati di microscopia ottica (IAOM), che sono stati utilizzati per la determinazione delle dimensioni granuli degli amidi di diverse specie, compreso il mais12,ilgrano 13,14,la patata 15 e l’orzo16,può misurare solo dimensioni 1D (di solito di lunghezza massima) o 2D (superficie) di numeri molto limitati (da decine a poche migliaia) di immagini di granuli di amido. Le piccole dimensioni di campionamento del granulo che sono intrinsecamente vincolate dalle tecniche potrebbero raramente essere statisticamente rappresentative, considerando gli enormi numeri di granuli per unità di peso dell’amido (~120 x 106 per grammo, assumendo tutte le sfere di 10 μm a densità di 1,5 g/cm³) e, quindi, potrebbero portare alla scarsa riproducibilità dei risultati. La tecnica Sd/StFFF può avere alta velocità e risoluzione, e frazioni di dimensioni ridotte di granuli di amido17, ma è stata usata raramente probabilmente perché la sua accuratezza potrebbe essere gravemente influenzata da danni, forme diverse e densità di granuli di amido. La tecnica di diffrazione laser è la più utilizzata ed è stata applicata per analisi delle dimensioni dei granuli di amido per tutte le principali specievegetali 3,14,16. Sebbene la tecnica abbia molti vantaggi, in realtà non è adatta per determinare le dimensioni dei granuli di amido in presenza di una distribuzione della forma del granulo. La maggior parte degli strumenti di diffrazione laser simultanei si basano sulla teoria dello scattering della luce mie18 per particelle sferiche uniformi e sulla teoria di Miemodificata 18 per alcune altre forme di uniformità. La tecnica è, quindi, intrinsecamente molto sensibile alle forme delle particelle, e non del tutto adatta anche per alcune forme diuniformità 19,figuriamoci per granuli di amido aventi una serie di forme di proporzioni variabili. La tecnica ESZ misura il disturbo del campo elettrico proporzionale al volume della particella che passa attraverso un’apertura. Fornisce dimensioni del volume del granulo, nonché informazioni sulla distribuzione del numero e del volume, ecc., ad alte risoluzioni. Poiché la tecnica ESZ è indipendente da qualsiasi proprietà ottica di particelle tra cui colore, forma, composizione o indice di rifrazione, e i risultati sono molto riproducibili, è particolarmente adatta per determinare la distribuzione delle dimensioni dei granuli di amido con un insieme di forme.
Anche le dimensioni dei granuli di amido sono state definite utilizzando molti parametri. Erano spesso descritti simplisticamente da diametri medi, che in alcuni casi erano i mezzi aritmetici delle lunghezze massime misurate microscopicamente delle immagini2D 12,20o medie di diametri disfera equivalenti 3. In altri casi, le distribuzioni delle dimensioni del granulo sono state specificate utilizzando gli intervallidi dimensioni 21,22, il volume medio di distribuzione o il diametro medio (equivalente sfera, ponderato per numero, volume o superficie) assumendo una distribuzionenormale 14,23,24,25,26. Questi descrittori delle dimensioni dei granuli di amido di varie analisi sono di natura molto diversa e non strettamente comparabili. Potrebbe essere molto fuorviante se queste “dimensioni” di granuli di amido di specie diverse o anche gli stessi tessuti della stessa specie fossero confrontati direttamente. Inoltre, il parametro di diffusione (o forma) delle distribuzioni normali ipotizzate, cioè la deviazione standard σ (o deviazione standard grafica σg) che misura la larghezza della distribuzione (cioè la diffusione delle dimensioni), è stato ignorato nella maggior parte degli studi.
Per risolvere i suddetti problemi critici relativi alle analisi di dimensionamento dei granuli di amido, abbiamo delineato una procedura per determinare in modo riproducibile e statisticamente valido le distribuzioni delle dimensioni dei granuli dei campioni di amido utilizzando la tecnica ESZ e per specificare correttamente le distribuzioni di dimensioni lognormali del granulo determinate utilizzando una forma moltiplicativa a due parametriadottata 27 con maggiore precisione e comparabilità. Per la convalida e la dimostrazione, abbiamo eseguito analisi di dimensionamento dei granuli replicati di campioni di amido sweetpotato utilizzando la procedura e specificato le distribuzioni di diametro del volume differenziale lognormale volume-percentuale equivalente-sfera utilizzando i loro mezzi 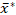 geometrici grafici e deviazioni standard moltiplicative s* in
geometrici grafici e deviazioni standard moltiplicative s* in 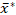 forma x/ (moltiplica e dividi) s*.
forma x/ (moltiplica e dividi) s*.
Protocol
Representative Results
Discussion
La procedura delineata ha risolto alcune criticità in diversi metodi esistenti per l’analisi delle dimensioni dei granuli di amido, tra cui il dimensionamento 1D o 2D inappropriato dei granuli 3D, la distorsione delle misure di dimensionamento a causa di forme di granuli non uniformi, scarsa riproducibilità e dubbia validità statistica a causa di dimensioni limitate del campione di granuli, specifiche imprecise o improprie (in particolare l’uso della dimensione media) delle dimensioni dei granuli in presenza sia di fo…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è in parte supportato dal Centro di ricerca sull’agricoltura cooperativa e dal Centro integrato di ricerca sulla sicurezza alimentare del College of Agriculture and Human Sciences, Prairie View A&M University. Ringraziamo Hua Tian per il suo supporto tecnico.
Materials
| Analytical beaker | Beckman Coulter Life Sciences | A35595 | Smart-Technology (ST) beaker |
| Aperture tube, 100 µm | Beckman Coulter Life Sciences | A36394 | For the MS4E, , 1000 µm |
| Disposable transfer pipettor, | Fisher Scientific (Fishersci.com) | 13-711-9AM | Other disposable transfer pipettors with similar orifice can also be used. |
| Fisherbrand Conical Polypropylene Centrifuge Tubes, 50 ml | Fisher Scientific (Fishersci.com) | 05-539-13 | Any other similar types of tubes can be used. |
| Glass beakers, 150 to 250 ml | Fisher Scientific (Fishersci.com) | 02-540K | These beakers are used to contain methanol for washing the aperture tube and stirer between runs. |
| LiCl | Fisher Chemical | L121-100 | |
| Methanol | Fisher Chemical | A412-500 | Buy in bulk as the analysis uses a large quantity of methanol. |
| Mettler Toledo ML-T Precision Balances | Mettler Toledo | 30243412 | Any other precision balance with a readablity 0.01 g to 1 mg will work. |
| Multisizer 4e Coulter Counter | Beckman Coulter Life Sciences | B23005 | The old model, Multisizer 3 can also be used with slight adjustment of parameters. The 4e model comes with a 100 μm aperture tube. Other aperture tubes of different diameter can be purchased separately from the company. |
| Ultrasonic processor UP50H | Hielscher Ultrasound Technology | UP50H | Other laborator sonicator having a low-power (<50 Watt) output can be also used. Both MS1 and MS2 sonotrodes for the particular sonicator can be used to disperse starch granules in 5 ml methanol. Always use the lowest setting first, 20% amplitude and 0.1 or 0.2 cycle, and raise the setting if aggregates persist in suspension. |
References
- Shannon, J. C., Garwood, D. L., Boyer, C. D., BeMiller, J., Whistler, R. . Starch:Chemistry and Technology Food Science and Technology. , 23-82 (2009).
- Singh, N., Singh, J., Kaur, L., Singh Sodhi, N., Singh Gill, B. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chemistry. 81 (2), 219-231 (2003).
- Lindeboom, N., Chang, P. R., Tyler, R. T. Analytical, biochemical and physicochemical aspects of starch granule size, with emphasis on small granule starches: a review. Starch – Stärke. 56 (34), 89-99 (2004).
- Baldwin, P. M., Davies, M. C., Melia, C. D. Starch granule surface imaging using low-voltage scanning electron microscopy and atomic force microscopy. International Journal of Biological Macromolecules. 21 (1-2), 103-107 (1997).
- Jane, J. L., Kasemsuwan, T., Leas, S., Zobel, H., Robyt, J. F. Anthology of starch granule morphology by scanning electron microscopy. Starch-Stärke. 46 (4), 121-129 (1994).
- Matsushima, R., Nakamura, Y. . Starch: Metabolism and Structure. , 425-441 (2015).
- Wang, S. -. q., Wanf, L. -. l., Fan, W. -. h., Cao, H., Cao, B. -. s. Morphological analysis of common edible starch granules by scanning electron microscopy. Food Science. 32 (15), 74-79 (2011).
- Baldwin, P. M., Adler, J., Davies, M. C., Melia, C. D. Holes in starch granules: confocal, SEM and light microscopy studies of starch granule structure. Starch-Stärke. 46 (9), 341-346 (1994).
- Chakraborty, I., Pallen, S., Shetty, Y., Roy, N., Mazumder, N. Advanced microscopy techniques for revealing molecular structure of starch granules. Biophysical Reviews. 12 (1), 105-122 (2020).
- Bechtel, D. B., Wilson, J. D. Amyloplast formation and starch granule development in hard red winter wheat. Cereal Chemistry. 80 (2), 175-183 (2003).
- Evers, A. Scanning electron microscopy of wheat starch. III. Granule development in the endosperm. Starch-Stärke. 23 (5), 157-162 (1971).
- Wang, Y. J., White, P., Pollak, L., Jane, J. L. Characterization of starch structures of 17 maize endosperm mutant genotypes with Oh43 inbred line background. Cereal Chemistry. 70, 171-179 (1993).
- Peng, M., Gao, M., Abdel-Aal, E. S. M., Hucl, P., Chibbar, R. N. Separation and characterization of A-and B-type starch granules in wheat endosperm. Cereal Chemistry. 76, 375-379 (1999).
- Wilson, J. D., Bechtel, D. B., Todd, T. C., Seib, P. A. Measurement of wheat starch granule size distribution using image analysis and laser diffraction technology. Cereal Chemistry. 83 (3), 259-268 (2006).
- Liu, Q., Weber, E., Currie, V., Yada, R. Physicochemical properties of starches during potato growth. Carbohydrate Polymers. 51 (2), 213-221 (2003).
- Chmelik, J., et al. Comparison of size characterization of barley starch granules determined by electron and optical microscopy, low angle laser light scattering and gravitational field-flow fractionation. Journal of the Institute of Brewing. 107 (1), 11-17 (2001).
- Moon, M. H., Giddings, J. C. Rapid separation and measurement of particle size distribution of starch granules by sedimentation/steric field-flow fractionation. Journal of Food Science. 58 (5), 1166-1171 (1993).
- Wriedt, T., Wolfram, H., Wriedt, T. . The Mie Theory: Basics and Applications. , 53-71 (2012).
- Schuerman, D. W., Wang, R. T., Gustafson, B. &. #. 1. 9. 7. ;. S., Schaefer, R. W. Systematic studies of light scattering. 1: Particle shape. Applied Optics. 20 (23), 4039-4050 (1981).
- Goering, K. J., Fritts, D. H., Eslick, R. F. A study of starch granule size and distribution in 29 barley varieties. Starch-Stärke. 25 (9), 297-302 (1973).
- Chen, Z., Schols, H. A., Voragen, A. G. J. Starch granule size strongly determines starch noodle processing and noodle quality. Journal of Food Sciences. 68 (5), 1584-1589 (2003).
- Dai, Z. M. Starch granule size distribution in grains at different positions on the spike of wheat (Triticum aestivum L.). Starch-Starke. 61 (10), 582-589 (2009).
- Edwards, M. A., Osborne, B. G., Henry, R. J. Effect of endosperm starch granule size distribution on milling yield in hard wheat. Journal of Cereal Science. 48 (1), 180-192 (2008).
- Karlsson, R., Olered, R., Eliasson, A. C. Changes in starch granule size distribution and starch gelatinization properties during development and maturation of wheat, barley and rye. Starch – Starke. 35 (10), 335-340 (1983).
- Li, W. -. Y., et al. Comparison of starch granule size distribution between hard and soft wheat cultivars in Eastern China. Agricultural Sciences China. 7 (8), 907-914 (2008).
- Park, S. H., Wilson, J. D., Seabourn, B. W. Starch granule size distribution of hard red winter and hard red spring wheat: Its effects on mixing and breadmaking quality. Journal of Cereal Science. 49 (1), 98-105 (2009).
- Limpert, E., Stahel, W. A., Abbt, M. Log-normal distributions across the sciences: keys and clues. Bioscience. 51 (5), 341-352 (2001).
- Gao, M., et al. Self-preserving lognormal volume-size distributions of starch granules in developing sweetpotatoes and modulation of their scale parameters by a starch synthase II (SSII). Acta Physiologiae Plantarum. 38 (11), 259 (2016).
- Wattebled, F., et al. STA11, a Chlamydomonas reinhardtii locus required for normal starch granule biogenesis, encodes disproportionating enzyme. Further evidence for a function of alpha-1,4 glucanotransferases during starch granule biosynthesis in green algae. Plant Physiology. 132 (1), 137-145 (2003).
- Ji, Y., Seetharaman, K., White, P. J. Optimizing a Small-Scale Corn-Starch Extraction Method for Use in the Laboratory. Cereal Chemistry. 81 (1), 55-58 (2004).
- Halloy, S., Whigham, P. The lognormal as universal descriptor of unconstrained complex systems: a unifying theory for complexity. Proceedings of the 7th Asia-Pacific Complex Systems Conference. , 309-320 (2004).
- Furusawa, C., Suzuki, T., Kashiwagi, A., Yomo, T., Kaneko, K. Ubiquity of log-normal distributions in intra-cellular reaction dynamics. Biophysics (Nagoya-shi). 1, 25-31 (2005).

