Análisis y especificación de distribuciones de tamaño de gránulo de almidón
Summary
Aquí se presenta un procedimiento para determinaciones reproducibles y estadísticamente válidas de distribuciones de tamaño de gránulo de almidón y para especificar las distribuciones de tamaño lognormal de gránulo determinada mediante un formulario multiplicativo de dos parámetros. Es aplicable a todos los análisis de tamaño de gránulos de muestras de almidón a escala de gram para la investigación de la ciencia vegetal y alimentaria.
Abstract
El almidón de todas las fuentes vegetales se compone de gránulos en una gama de tamaños y formas que tienen diferentes frecuencias de ocurrencia, es decir, exhibiendo un tamaño y una distribución de laforma. Los datos de tamaño de gránulo de almidón determinados utilizando varios tipos de técnicas de dimensionamiento de partículas a menudo son problemáticos debido a la mala reproducibilidad o la falta de significación estadística resultante de algunos errores sistemáticos insuperables, incluyendo sensibilidad a las formas de gránulos y límites de tamaños de muestras de gránulos. Delineamos un procedimiento para determinaciones reproducibles y estadísticamente válidas de distribuciones de tamaño de gránulo de almidón utilizando la técnica de zona de detección eléctrica, y para especificar las distribuciones de tamaño lognormal de gránulos determinadas utilizando una forma multiplicativa de dos parámetros adoptada con mayor precisión y comparabilidad. Es aplicable a todos los análisis de tamaño de gránulos de muestras de almidón a escala de gram, y, por lo tanto, podría facilitar estudios sobre cómo los tamaños de gránulos de almidón son moldeados por el aparato y mecanismos de biosíntesis de almidón; y cómo afectan a las propiedades y funcionalidades de los almidones para usos alimentarios e industriales. Los resultados representativos se presentan a partir de análisis de réplicas de distribuciones de tamaño de gránulo de muestras de almidón de camote utilizando el procedimiento descrito. Además, discutimos varios aspectos técnicos clave del procedimiento, especialmente, la especificación multiplicativa de las distribuciones de tamaño lognormal de gránulos y algunos medios técnicos para superar el bloqueo frecuente de apertura por agregados de gránulos.
Introduction
Los gránulos de almidón son la estructura física en la que dos polímeros homoglucanos de reserva principal en la fotosíntesis vegetal y los tejidos de almacenamiento, la amilosa lineal o escasamente ramificada y la amiloidpectina altamente ramificada, están embalados ordenadamente junto con algunos componentes menores, incluyendo lípidos y proteínas. Los gránulos de almidón de varias especies vegetales exhiben muchas formas tridimensionales (3D) (revisadas en los puntos1,2),incluyendo esferas, elipsoides, poliedro, plaquetas, cubos, cuboides y túbulos irregulares. Incluso aquellos del mismo tejido o diferentes tejidos de la misma especie vegetal podrían tener un conjunto de formas con diferentes frecuencias de ocurrencia. En otras palabras, los gránulos de almidón de una especie vegetal pueden tener una distribución característica de la forma estadística, en lugar de una forma específica. Las formas de gránulos no uniformes y no esféricos hacen que sea difícil medir y definir correctamente los tamaños de gránulos de almidón. Además, los gránulos de almidón de los mismos tejidos de una especie vegetal son de una gama de tamaños con diferentes proporciones, es decir, exhibiendo una distribución de tamaño característica. Esta distribución del tamaño complica aún más el análisis y la descripción de los tamaños de gránulos de almidón.
Los tamaños de gránulos de almidón se han analizado utilizando varias categorías de técnicas de dimensionamiento de partículas (revisadas en la referencia3),incluyendo microscopía, sedimentación/fraccionamiento de flujo de campo estetérico (Sd/StFFF), difracción láser y zona de detección eléctrica (ESZ). Sin embargo, estas técnicas no son igualmente adecuadas para la determinación de tamaños de gránulos de almidón en presencia de una forma de gránulo y una distribución de tamaño. La microscopía, incluyendo microscopía electrónica ligera, confocal y de barrido, es excelente para los estudios de morfología4,5,6,7,estructura8,9 y desarrollo10,11 de gránulos de almidón, pero difícilmente adecuado para definir sus distribuciones de tamaño debido a algunas deficiencias inherentes. Mediciones directas de imágenes microscópicas de gránulos o análisis de imágenes asistidas por software de datos de microscopía óptica (IAOM), que se han utilizado para la determinación de tamaños de gránulos de almidones de varias especies, incluyendo maíz12,trigo13,14,papa15 y cebada16,puede medir sólo 1D (generalmente longitud máxima) o 2D (superficie) tamaños de números muy limitados (decenas a unos pocos miles) de imágenes de gránulos de almidón. Los pequeños tamaños de muestreo de gránulos que están inherentemente limitados por las técnicas rara vez podrían ser estadísticamente representativos, teniendo en cuenta los enormes números de gránulos por unidad de peso de almidón (~ 120 x 106 por gramo, asumiendo todas las esferas de 10 μm a 1,5 g/cm³ de densidad), y, por lo tanto, podría conducir a la mala reproducibilidad de los resultados. La técnica Sd/StFFF puede tener alta velocidad y resolución, y fracciones de tamaño estrecho de gránulos de almidón17,pero rara vez se ha utilizado probablemente porque su precisión podría verse gravemente afectada por daños, diferentes formas y densidad de gránulos de almidón. La técnica de difracción láser es la más utilizada, y se ha aplicado para análisis del tamaño del gránulo de almidón para todas las especies de cultivos principales3,14,16. Aunque la técnica tiene muchas ventajas, en realidad no es adecuada para determinaciones de tamaños de gránulos de almidón en presencia de una distribución de forma de gránulo. La mayoría de los instrumentos de difracción láser concurrentes se basan en la teoría de dispersión de luz Mie18 para partículas esféricas uniformes y la teoría mie modificada18 para algunas otras formas de uniformidad. La técnica es, por lo tanto, inherentemente muy sensible a las formas de partículas, y no es del todo adecuada incluso para ciertas formas de uniformidad19,y mucho menos para los gránulos de almidón que tienen un conjunto de formas de diferentes proporciones. La técnica ESZ mide la perturbación del campo eléctrico proporcional al volumen de la partícula que pasa a través de una abertura. Proporciona tamaños de volumen de gránulos, así como la información de distribución de número y volumen, etc., a altas resoluciones. Dado que la técnica ESZ es independiente de cualquier propiedad óptica de partículas como el color, la forma, la composición o el índice refractario, y los resultados son muy reproducibles, es particularmente adecuado para determinar las distribuciones de tamaño de los gránulos de almidón que tienen un conjunto de formas.
Los tamaños de gránulo de almidón también se han definido mediante el uso de muchos parámetros. A menudo fueron descritos simplistamente por diámetros medios, que en algunos casos eran los medios aritméticos de las longitudes máximas microscópicamente medidas de imágenes 2D12,20, o promedios de diámetros de esfera equivalentes3. En otros casos, las distribuciones de tamaño de gránulo se especificaron utilizando rangos de tamaño21,22, el volumen medio de distribución o diámetro medio (equivalente a esfera, ponderado por número, volumen o superficie) suponiendo una distribución normal14,23,24,25,26. Estos descriptores de tamaños de gránulos de almidón de varios análisis son de una naturaleza muy diferente, y no estrictamente comparables. Podría ser muy engañoso si estos “tamaños” de gránulos de almidón de diferentes especies o incluso los mismos tejidos de la misma especie fueran comparados directamente. Además, el parámetro de dispersión (o forma) de las distribuciones normales asumidas, es decir, la desviación estándar σ (o desviación estándar gráfica σg)que mide el ancho de la distribución (es decir, la dispersión de los tamaños), se ha ignorado en la mayoría de los estudios.
Para resolver los problemas críticos antes mencionados que enfrentan los análisis de tamaño de gránulos de almidón, delineamos un procedimiento para determinar reproducibles y estadísticamente válidos las distribuciones de tamaño de gránulo de muestras de almidón utilizando la técnica ESZ, y para especificar correctamente las distribuciones de tamaño lognormal de gránulos determinadas utilizando una forma multiplicativa de dos parámetros adoptada27 con mayor precisión y comparabilidad. Para la validación y demostración, realizamos análisis de tamaño de gránulo de réplica de muestras de almidón de camote utilizando el procedimiento, y especificamos las distribuciones de volumen diferencial lognormal de volumen-volumen equivalente-esfera de diámetro utilizando sus medios geométricos gráficos 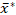 y desviaciones estándar multiplicativas s* en una forma
y desviaciones estándar multiplicativas s* en una forma 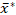 x/ (multiplicar y dividir).
x/ (multiplicar y dividir).
Protocol
Representative Results
Discussion
El procedimiento descrito ha resuelto algunos problemas críticos en varios métodos existentes para los análisis del tamaño de gránulos de almidón, incluyendo el tamaño inadecuado 1D o 2D de gránulos 3D, la distorsión de las mediciones de tamaño debido a formas de gránulos no uniformes, mala reproducibilidad y dudosa validez estadística debido a tamaños limitados de muestras de gránulos, especificación inexacta o incorrecta (especialmente el uso del tamaño promedio) de tamaños de gránulos en presencia de…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabajo cuenta con el apoyo parcial del Centro de Investigación Cooperativa de Agricultura y el Centro Integrado de Investigación en Seguridad Alimentaria de la Facultad de Agricultura y Ciencias Humanas de la Universidad Prairie View A&M. Agradecemos a Hua Tian por su apoyo técnico.
Materials
| Analytical beaker | Beckman Coulter Life Sciences | A35595 | Smart-Technology (ST) beaker |
| Aperture tube, 100 µm | Beckman Coulter Life Sciences | A36394 | For the MS4E, , 1000 µm |
| Disposable transfer pipettor, | Fisher Scientific (Fishersci.com) | 13-711-9AM | Other disposable transfer pipettors with similar orifice can also be used. |
| Fisherbrand Conical Polypropylene Centrifuge Tubes, 50 ml | Fisher Scientific (Fishersci.com) | 05-539-13 | Any other similar types of tubes can be used. |
| Glass beakers, 150 to 250 ml | Fisher Scientific (Fishersci.com) | 02-540K | These beakers are used to contain methanol for washing the aperture tube and stirer between runs. |
| LiCl | Fisher Chemical | L121-100 | |
| Methanol | Fisher Chemical | A412-500 | Buy in bulk as the analysis uses a large quantity of methanol. |
| Mettler Toledo ML-T Precision Balances | Mettler Toledo | 30243412 | Any other precision balance with a readablity 0.01 g to 1 mg will work. |
| Multisizer 4e Coulter Counter | Beckman Coulter Life Sciences | B23005 | The old model, Multisizer 3 can also be used with slight adjustment of parameters. The 4e model comes with a 100 μm aperture tube. Other aperture tubes of different diameter can be purchased separately from the company. |
| Ultrasonic processor UP50H | Hielscher Ultrasound Technology | UP50H | Other laborator sonicator having a low-power (<50 Watt) output can be also used. Both MS1 and MS2 sonotrodes for the particular sonicator can be used to disperse starch granules in 5 ml methanol. Always use the lowest setting first, 20% amplitude and 0.1 or 0.2 cycle, and raise the setting if aggregates persist in suspension. |
References
- Shannon, J. C., Garwood, D. L., Boyer, C. D., BeMiller, J., Whistler, R. . Starch:Chemistry and Technology Food Science and Technology. , 23-82 (2009).
- Singh, N., Singh, J., Kaur, L., Singh Sodhi, N., Singh Gill, B. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chemistry. 81 (2), 219-231 (2003).
- Lindeboom, N., Chang, P. R., Tyler, R. T. Analytical, biochemical and physicochemical aspects of starch granule size, with emphasis on small granule starches: a review. Starch – Stärke. 56 (34), 89-99 (2004).
- Baldwin, P. M., Davies, M. C., Melia, C. D. Starch granule surface imaging using low-voltage scanning electron microscopy and atomic force microscopy. International Journal of Biological Macromolecules. 21 (1-2), 103-107 (1997).
- Jane, J. L., Kasemsuwan, T., Leas, S., Zobel, H., Robyt, J. F. Anthology of starch granule morphology by scanning electron microscopy. Starch-Stärke. 46 (4), 121-129 (1994).
- Matsushima, R., Nakamura, Y. . Starch: Metabolism and Structure. , 425-441 (2015).
- Wang, S. -. q., Wanf, L. -. l., Fan, W. -. h., Cao, H., Cao, B. -. s. Morphological analysis of common edible starch granules by scanning electron microscopy. Food Science. 32 (15), 74-79 (2011).
- Baldwin, P. M., Adler, J., Davies, M. C., Melia, C. D. Holes in starch granules: confocal, SEM and light microscopy studies of starch granule structure. Starch-Stärke. 46 (9), 341-346 (1994).
- Chakraborty, I., Pallen, S., Shetty, Y., Roy, N., Mazumder, N. Advanced microscopy techniques for revealing molecular structure of starch granules. Biophysical Reviews. 12 (1), 105-122 (2020).
- Bechtel, D. B., Wilson, J. D. Amyloplast formation and starch granule development in hard red winter wheat. Cereal Chemistry. 80 (2), 175-183 (2003).
- Evers, A. Scanning electron microscopy of wheat starch. III. Granule development in the endosperm. Starch-Stärke. 23 (5), 157-162 (1971).
- Wang, Y. J., White, P., Pollak, L., Jane, J. L. Characterization of starch structures of 17 maize endosperm mutant genotypes with Oh43 inbred line background. Cereal Chemistry. 70, 171-179 (1993).
- Peng, M., Gao, M., Abdel-Aal, E. S. M., Hucl, P., Chibbar, R. N. Separation and characterization of A-and B-type starch granules in wheat endosperm. Cereal Chemistry. 76, 375-379 (1999).
- Wilson, J. D., Bechtel, D. B., Todd, T. C., Seib, P. A. Measurement of wheat starch granule size distribution using image analysis and laser diffraction technology. Cereal Chemistry. 83 (3), 259-268 (2006).
- Liu, Q., Weber, E., Currie, V., Yada, R. Physicochemical properties of starches during potato growth. Carbohydrate Polymers. 51 (2), 213-221 (2003).
- Chmelik, J., et al. Comparison of size characterization of barley starch granules determined by electron and optical microscopy, low angle laser light scattering and gravitational field-flow fractionation. Journal of the Institute of Brewing. 107 (1), 11-17 (2001).
- Moon, M. H., Giddings, J. C. Rapid separation and measurement of particle size distribution of starch granules by sedimentation/steric field-flow fractionation. Journal of Food Science. 58 (5), 1166-1171 (1993).
- Wriedt, T., Wolfram, H., Wriedt, T. . The Mie Theory: Basics and Applications. , 53-71 (2012).
- Schuerman, D. W., Wang, R. T., Gustafson, B. &. #. 1. 9. 7. ;. S., Schaefer, R. W. Systematic studies of light scattering. 1: Particle shape. Applied Optics. 20 (23), 4039-4050 (1981).
- Goering, K. J., Fritts, D. H., Eslick, R. F. A study of starch granule size and distribution in 29 barley varieties. Starch-Stärke. 25 (9), 297-302 (1973).
- Chen, Z., Schols, H. A., Voragen, A. G. J. Starch granule size strongly determines starch noodle processing and noodle quality. Journal of Food Sciences. 68 (5), 1584-1589 (2003).
- Dai, Z. M. Starch granule size distribution in grains at different positions on the spike of wheat (Triticum aestivum L.). Starch-Starke. 61 (10), 582-589 (2009).
- Edwards, M. A., Osborne, B. G., Henry, R. J. Effect of endosperm starch granule size distribution on milling yield in hard wheat. Journal of Cereal Science. 48 (1), 180-192 (2008).
- Karlsson, R., Olered, R., Eliasson, A. C. Changes in starch granule size distribution and starch gelatinization properties during development and maturation of wheat, barley and rye. Starch – Starke. 35 (10), 335-340 (1983).
- Li, W. -. Y., et al. Comparison of starch granule size distribution between hard and soft wheat cultivars in Eastern China. Agricultural Sciences China. 7 (8), 907-914 (2008).
- Park, S. H., Wilson, J. D., Seabourn, B. W. Starch granule size distribution of hard red winter and hard red spring wheat: Its effects on mixing and breadmaking quality. Journal of Cereal Science. 49 (1), 98-105 (2009).
- Limpert, E., Stahel, W. A., Abbt, M. Log-normal distributions across the sciences: keys and clues. Bioscience. 51 (5), 341-352 (2001).
- Gao, M., et al. Self-preserving lognormal volume-size distributions of starch granules in developing sweetpotatoes and modulation of their scale parameters by a starch synthase II (SSII). Acta Physiologiae Plantarum. 38 (11), 259 (2016).
- Wattebled, F., et al. STA11, a Chlamydomonas reinhardtii locus required for normal starch granule biogenesis, encodes disproportionating enzyme. Further evidence for a function of alpha-1,4 glucanotransferases during starch granule biosynthesis in green algae. Plant Physiology. 132 (1), 137-145 (2003).
- Ji, Y., Seetharaman, K., White, P. J. Optimizing a Small-Scale Corn-Starch Extraction Method for Use in the Laboratory. Cereal Chemistry. 81 (1), 55-58 (2004).
- Halloy, S., Whigham, P. The lognormal as universal descriptor of unconstrained complex systems: a unifying theory for complexity. Proceedings of the 7th Asia-Pacific Complex Systems Conference. , 309-320 (2004).
- Furusawa, C., Suzuki, T., Kashiwagi, A., Yomo, T., Kaneko, K. Ubiquity of log-normal distributions in intra-cellular reaction dynamics. Biophysics (Nagoya-shi). 1, 25-31 (2005).

