Эксперимент с использованием функциональной ближней инфракрасной спектроскопии и роботизированных многосуставных точечных движений нижней конечности
Summary
Подсчитано, что у 1 из 6 человек во всем мире в течение жизни случается инсульт, приводящий к длительной инвалидности, механизмы реабилитации которого до сих пор плохо изучены. В этом исследовании предлагается протокол для оценки активации мозга с помощью функциональной спектроскопии ближнего инфракрасного диапазона (fNIRS) во время сеанса роботизированной терапии нижних конечностей.
Abstract
Ежегодно от инсульта страдают около 17 миллионов человек во всем мире и он является одной из основных причин длительной инвалидности. Роботизированная терапия показала многообещающие результаты в оказании помощи пациентам с инсультом в восстановлении утраченных двигательных функций. Одним из потенциальных путей для углубления понимания того, как происходит восстановление моторики, является изучение активации мозга во время движений, на которые нацелена терапия у здоровых людей. Функциональная спектроскопия ближнего инфракрасного диапазона (fNIRS) стала многообещающим методом нейровизуализации для изучения нейронных основ двигательной функции. Целью данного исследования было изучение нейронных коррелятов сложных движений нижних конечностей у здоровых испытуемых. Участникам было предложено выполнять циклы отдыха и движения в течение 6 минут, используя роботизированное устройство для двигательной реабилитации. Задание требовало скоординированных движений коленного и голеностопного суставов, чтобы указывать на цели, отображаемые на экране компьютера. Были исследованы два экспериментальных условия с разным уровнем помощи в движении, предоставляемой роботом. Результаты показали, что протокол fNIRS эффективно выявлял области мозга, связанные с моторным контролем во время выполнения задания. Примечательно, что у всех испытуемых наблюдалась большая активация в контралатеральной премоторной области во время отсутствия помощи по сравнению с вспомогательным состоянием. В заключение, fNIRS представляется ценным подходом для выявления изменений концентрации оксигемоглобина, связанных с многосуставными точечными движениями нижней конечности. Это исследование может способствовать пониманию механизмов восстановления после инсульта и может проложить путь к улучшению реабилитационных методов лечения пациентов с инсультом. Тем не менее, необходимы дальнейшие исследования, чтобы полностью прояснить потенциал fNIRS в изучении двигательной функции и ее применение в клинических условиях.
Introduction
Эпидемиологические данные свидетельствуют о том, что ежегодно во всем мире регистрируется ~17 миллионов новых случаев инсульта, при этом рост заболеваемости наблюдаетсяв странах с низким и средним уровнем дохода1. По оценкам, к 2030 г. число новых случаев заболевания увеличится до 77 миллионов2. Двигательные нарушения, вызванные инсультом, часто влияют на подвижность пациента и его участие в повседневной жизни, способствуя низкому качеству жизни. Традиционная двигательная реабилитация включает в себя мануальную терапию, но за последние несколько десятилетий были разработаны роботизированные системы для реабилитации. Эти системы могут обеспечивать терапию с высокой интенсивностью, дозой, количественной поддаемостью, надежностью, повторяемостью и гибкостью3 и продемонстрировали потенциал в качестве эффективных реабилитационных методов лечения как для острых, так и для хронических пациентов с инсультом 4,5,6. В дополнение к проведению терапии, роботизированные системы для реабилитации могут использоваться в качестве оценочных инструментов, поскольку они могут быть оснащены датчиками, которые могут измерять кинематические/кинетические данные движения пациента 7,8. Для двигательной реабилитации верхних конечностей такие данные не только оказались полезными для оценки уровня двигательного восстановления пациента с помощью роботизированной терапии и послужили дополнительным инструментом к традиционным клиническим оценкам 9,10, но и способствовали углублению понимания процесса восстановления моторики после инсульта11. 12, а также нейронный контроль движения и моторного обучения у здоровых людей 3,13,14. В результате, эти результаты послужили основой для совершенствования реабилитационных методовлечения 15.
За последние два десятилетия было предложено множество роботизированных устройств для нейрореабилитации нижних конечностей, начиная от экзоскелетов, которые поддерживают вес тела пациента во время ходьбы (например, на беговой дорожке, такой как Lokomat16), и заканчивая стационарными роботизированными системами, которые позволяют пациенту тренировать голеностопный, коленный или стопный суставы без ходьбы (например, Rutgers Ankle17, Высокопроизводительный робот для реабилитации голеностопного сустава18 и робот для реабилитации голеностопного сустава и стопы Института науки и технологий Кванджу (GIST)19) или активные ортезы стопы, которые представляют собой приводимые в действие экзоскелеты, которые пациент носит для ходьбы по земле или по беговой дорожке (например, ортез для ходьбы с электроприводом20 и робот MIT Anklebot21). Смотрите 22,23,4 обзор роботов для реабилитации нижних конечностей.
Результаты клинических исследований роботизированных устройств для реабилитации нижних конечностей у пациентов, перенесших инсульт, были обнадеживающими и показали, что эти системы могут улучшать диапазон движений суставов (ROM), мышечную силу или походку, в зависимости от конкретного устройства и клинического протокола (см. 24,25 обзор эффективности роботов для нижних конечностей для реабилитации). В то время как было постулировано, что робот-ассистированная терапия способствует нейропластическим изменениям, которые в конечном итоге приводят к улучшению двигательных способностей26, остается в основном неясным, как именно происходит процесс восстановления двигательных способностей после инсульта и какие протоколы роботизированной тренировки оптимизируют процесс восстановления двигательных способностей нижних конечностей. На самом деле, существует значительное, растущее несоответствие между растущим развитием реабилитационных роботов (как академическими исследователями, так и коммерческими организациями) и ограниченным пониманием нейрофизиологических механизмов, лежащих воснове восстановления моторики. Измерения кинематики движений или крутящих моментов суставов, выполненные с помощью встроенных датчиков, способствовали количественному описанию изменений в двигательном поведении, которые происходят по мере восстановления двигательных способностей нижних конечностейпациентов 27,28,29, частично заполняя этот пробел. Однако нейронные корреляты, лежащие в основе таких изменений, были менее изучены. Это обусловлено несколькими причинами.
Функциональная визуализация головного мозга отнимает много времени и иногда ее трудно выполнить в контексте клинических испытаний, которые часто требуют свести к минимуму нагрузку на пациента, чтобы максимизировать вероятность приверженности пациента к исследованию. Это особенно верно для людей, перенесших инсульт, учитывая тот факт, что постинсультная усталость и мышечная слабостьчасто наблюдаются. Кроме того, методы визуализации, основанные на магнитных полях, такие как функциональная магнитно-резонансная томография (фМРТ), требуют, чтобы как пациент, так и роботизированное оборудование были безопасными для магнитов.
Среди неинвазивных методов визуализации функциональная спектроскопия ближнего инфракрасного диапазона (fNIRS) является методом визуализации, особенно подходящим для оценки областей активации мозга у пациентов, проходящих роботизированную терапию. Аналогично фМРТ, fNIRS измеряет оксигенацию/деоксигенацию крови в головном мозге. Однако, в отличие от фМРТ, fNIRS полностью совместим с роботизированным оборудованием и часто является портативным, даже может быть использован у постели больного. Также fNIRS имеет низкую стоимость и меньшую чувствительность к артефактам движения 31,32,33.
Несмотря на его явные преимущества и широкое использование во многих клинических условиях с момента его первого появления в конце70-х годов, только в нескольких исследованиях fNIRS использовали для количественной оценки активации мозга, связанной с движениями нижних конечностей и восстановлением инсультной моторики. Исследования FNIRS, направленные на выяснение механизмов нейронного контроля движений и/или механизмов или оценку восстановления моторики после инсульта, в основном изучали движения одного сустава (например, тыльное сгибание, подошвенное сгибание или разгибание коленного сустава 35,36,37), ходьбу 38,39,40,41,42,43 или езду на велосипеде44. Смотрите45 для обзора. Аналогичным образом, исследования fNIRS по робот-ассистированной терапии нижних конечностей в основном были сосредоточены на робот-ассистированной реабилитации ходьбы; Смотрите46 для обзора. Несколько исследований были сосредоточены на использовании fNIRS как части системы интерфейса мозг-компьютер (BCI) для получения управляющих сигналов для роботизированных устройств47,48; Несмотря на то, что эта область исследований также опирается на обработку сигналов fNIRS, ее цель иная и в основном сосредоточена на расшифровке намерений пациента (например, пациентов с тяжелыми двигательными нарушениями).
Пилотное исследование, представленное в настоящем документе, является частью первоначальных усилий по изучению эффектов роботизированной системы для реабилитации нижних конечностей. Робот может проводить целенаправленную реабилитацию нижних конечностей, которая включает в себя обучение повседневным многосуставным движениям, а также проводить терапию отдельных суставов (например, коленного или голеностопного) нижней конечности (т.е. реализовывать программу реабилитации снизу вверх).
Исследование было направлено на изучение осуществимости экспериментального протокола, который требовал получения данных fNIRS во время выполнения многосуставных точечных движений нижних конечностей. Продолжительность периода сбора данных в этом исследовании, которая была ограничена 6 минутами, короче, чем у типичных протоколов fNIRS. Это был осознанный выбор, сделанный с целью повышения практичности и клинической применимости этого исследования, особенно у пациентов с ограниченной подвижностью или силой. Идентификация коррелятов fNIRS таких сложных многосуставных движений и получение информации о том, как активация мозга модулируется с помощью робота, также представляли интерес. Для этого были проведены две сессии экспериментов с одними и теми же участниками: одна без помощи робота, а другая с помощью робота. Наконец, важно отметить, что это исследование было сосредоточено на здоровых людях, чтобы заложить основу для будущих исследований с точки зрения выполнимости протокола регистрации и оценки активации мозга во время движений, направленных на роботизированную терапию.
Аппарат
Для проведения наших экспериментов использовался портативный робот, предназначенный для реабилитации нижних конечностей (см. рис. 1). Робот имеет 3D-доступное рабочее пространство, он компактный и легкий, весит около 35 фунтов, что упрощает его транспортировку и установку.
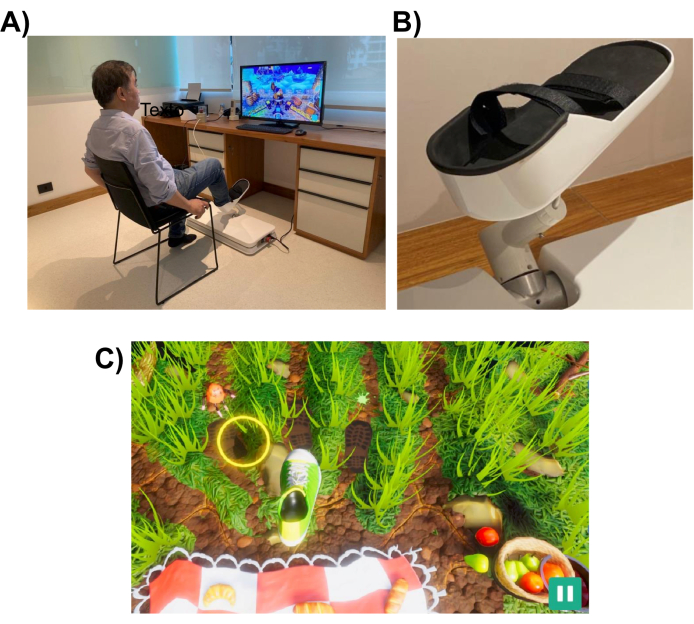
Рисунок 1: Экспериментальная установка. (А) Роботизированная система (установленная на полу), предназначенная для нижних конечностей. Показано, как доброволец использует интерфейс правой ногой. (B) Опорная конструкция для стопы субъекта, которая позволяет прикрепляться к роботизированной системе. (C) Скриншот игры «Пикник». Цель игры состоит в том, чтобы переместить ногу (зеленый и белый ботинок) к цели (желтый круг). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Роботизированная система предназначена для оказания помощи пациенту в выполнении движений нижних конечностей, аналогичных тем, которые выполняются при выполнении повседневных задач, таких как указание или удар ногой. В нем используются интерактивные игры виртуальной реальности, которые отображаются на мониторе компьютера или телевизионном экране, размещенном перед роботизированным устройством (см. рис. 1). Эффектор роботизированного конца прикрепляется к нижней конечности пациента (например, лодыжке), и его положение сопоставляется с положением курсора на экране. Типичная игра показывает пациенту цели движения (например, объект, на который нужно указать или куда ударить по мячу).
Чтобы выполнить задачу движения, робот может помочь пациенту с таким уровнем помощи, который может варьироваться от полной помощи до ее отсутствия. Уровень роботизированной помощи выбирается в начале каждого сеанса реабилитации исходя из уровня двигательных нарушений пациента. Движения, выполняемые испытуемым, используются игрой для оценки производительности пациента и предоставления ему обратной связи о его работе (например, ROM, количество движений и уровень роботизированной помощи). Игры разработаны таким образом, чтобы быть интерактивными и развлекательными, чтобы поддерживать интерес и внимание пациентов. В этом исследовании участники играли в «Игру в пикник», в которой игрок должен был помешать насекомым добраться до полотенца и украсть еду (см. рисунок 1, нижняя панель, скриншот).
Сбор данных осуществлялся с помощью портативной системы сбора данных fNIRS с двумя различными непрерывными оптодами (760 нм и 850 нм), 8 светодиодными источниками с двумя наконечниками и 8 активными детекторами с двумя наконечниками. Сигналы регистрировались с частотой дискретизации 10,17 Гц. Для оптимизации калибровки и записи сигнала использовался ноутбук с использованием сети Wi-Fi, созданной системой fNIRS.
Для удержания оптодов в заранее определенных местах использовался колпачок. Источники и детекторы размещались по международной системе ЭЭГ 10-10 в пространственном распределении сетки. Каждый канал fNIRS определялся парой источник-детектор с межоптодными расстояниями около 30 мм. Оптоды были размещены над дополнительными моторными, предмоторными и моторными областями в местах, показанных на рисунке 2. Общее количество каналов составило 28, из которых 8 были каналами малого расстояния, которые были подключены к каждому источнику с помощью волоконно-оптического адаптера к одному детектору. Учитывая мультиплексирование аппаратного обеспечения, можно получать информацию на коротких расстояниях от всех источников, используя только один детектор.
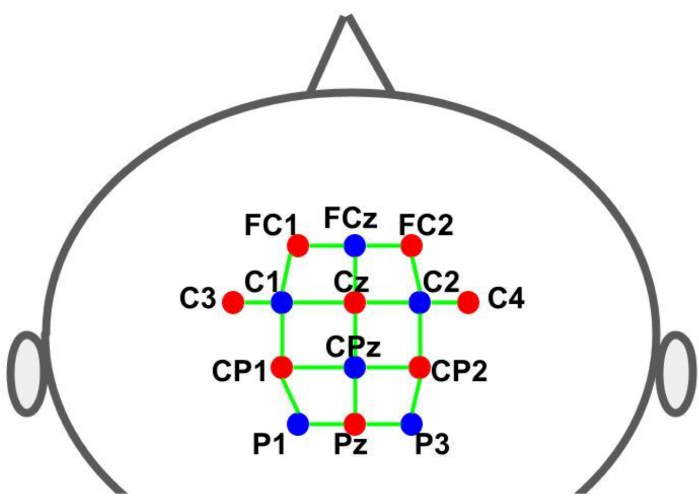
Рисунок 2: Монтаж макета с использованием системы 10-10 ЭЭГ. Буквы и цифры обозначают местоположение источника/детектора. Красными и синими точками обозначены оптоды источника и детектора соответственно. Зелеными линиями обозначены каналы fNIRS, состоящие из пар источника и детектора. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Экспериментальный дизайн
Эксперимент проводился в двух различных экспериментальных условиях, различающихся по уровню помощи, оказываемой роботом движениям испытуемого. В первом условии робот был запрограммирован на то, чтобы не оказывать никакой помощи в движениях субъекта, в то время как во втором условии робот контролировал движения ног и ног субъекта (роботизированное движение).
Каждый эксперимент следовал парадигме блочного дизайна, включающей чередование циклов двигательной задачи (игра – 30 с) и отдых (30 с), как показано на рисунке 3. Начало и окончание каждой фазы (игра/игра или отдых) визуально сигнализировались испытуемому через экран компьютера. Во время фазы покоя отображалось сообщение, указывающее на паузу. Каждый цикл (игра/игра + отдых) длился 60 секунд и повторялся шесть раз, в результате чего общее время выполнения составляло 360 секунд (6 минут).
Участники играли в «Игру-пикник», в которой цель состояла в том, чтобы не дать насекомым добраться до полотенца и украсть еду. Эта игра включала в себя последовательность движений нижними конечностями, начиная с назначенной домашней цели (начальная позиция) и продолжаясь к одной из трех внешних целей, прежде чем вернуться к домашней цели. На экране внешние мишени визуально представлялись в виде анимированных движущихся насекомых, до которых участники должны были дотянуться и наступить на них. Было три внешние мишени, каждая из которых случайным образом появлялась равное количество раз, наряду с общей домашней мишенью для каждого движения. Расстояние, которое нога должна была пройти от домашней цели до позиции внешних мишеней, образовывало дугу, примерно равную 26 см. Двигательная задача требовала выполнения многосуставных движений, что требовало координации между сгибанием/разгибанием колена, подошвенным сгибанием и тыльным сгибанием.
Записи данных fNIRS были синхронизированы с визуальными стимулами, предъявляемыми игрой испытуемому через импульс транзистор-транзисторная логика (TTL), генерируемый роботом. Импульсы генерировались в начале каждой фазы (игра/игра и отдых). Таким образом, весь контроль времени осуществлялся игрой, которая предоставляла участнику визуальные подсказки (цели) для начала каждого движения, посылала сигналы TTL в систему fNIRS для маркировки записей мозговой активности и, если того требовал эксперимент, посылала сигналы в систему управления роботом для инициирования помощи в движении.
Protocol
Representative Results
Discussion
В этом экспериментальном исследовании была изучена возможность делать выводы о картировании активации мозга с использованием данных fNIRS у здоровых испытуемых, когда они выполняли различные типы движений с использованием робота для реабилитации нижних конечностей. Типичные сеансы за…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Мнения, гипотезы, выводы и рекомендации данного исследования принадлежат авторам и не обязательно отражают мнения финансирующего учреждения. JRS благодарит Исследовательский фонд Сан-Паулу (FAPESP, номера грантов 2021/05332-8, 2018/04654-9, 2018/21934-5 и 2023/02538-0) и Джексона Сионека за технологическую поддержку. AMM и Vivax Ltda выражают благодарность FAPESP (Исследовательский фонд Сан-Паулу) и FINEP (Бразильское агентство инноваций). Этот проект финансировался за счет грантов FAPESP (номер гранта 2018/09559-4) и FINEP (номер гранта 2019/09933-6).
Materials
| 32 inch Smart TV | Samsung | N/A | TV connected to robot via HDMI cable |
| 8-detector silicon photodiode (SiPD) optodes for optical detection with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| 8-source optodes bundle for optical illumination with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Aurora acquisition software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Laptop Precision XPS 13 | Dell Technologies (Round Rock, TX, USA) | ||
| nirsLAB fNIRS Analysis software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| NIRSports2 fNIRS acquisition system | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | It has two different continuous wave optics (760 and 850 nm), 8 dual-ended LED sources and 8 dual-ended active detectors. |
| R | R-project.org (open source software) | https://www.r-project.org/ | |
| Standard cut cap, black color for up to 128 holders. | Easycap GmbH (Wörthsee, Germany) | https://www.easycap.de/ | |
| Vivax Assistive Rehabilitation Machine (ARM) | Vivax Ltda (São Paulo, Brazil) | https://vivaxbr.com/home/ | It is a portable robot designed to deliver lower limb rehabilitation. It has a 3D reachable workspace and is compact and light, weighing about 35 lb., which makes it easy to transport and to install. |
References
- GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. Neurology. 18 (5), 439-458 (2019).
- GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. The Lancet. Neurology. 20 (10), 795-820 (2021).
- Huang, V. S., Krakauer, J. W. Robotic neurorehabilitation: a computational motor learning perspective. Journal of NeuroEngineering and Rehabilitation. 6, 5 (2009).
- Hobbs, B., Artemiadis, P. A Review of Robot-Assisted Lower-Limb Stroke Therapy: Unexplored Paths and Future Directions in Gait Rehabilitation. Frontiers in neurorobotics. 14, 19 (2020).
- Bertani, R., Melegari, C., De Cola, M. C., Bramanti, A., Bramanti, P., Calabrò, R. S. Effects of robot-assisted upper limb rehabilitation in stroke patients: a systematic review with meta-analysis. Neurological Sciences. 38 (9), 1561-1569 (2017).
- Warutkar, V., Dadgal, R., Mangulkar, U. R. Use of robotics in gait rehabilitation following stroke: A review. Cureus. 14 (11), e31075 (2022).
- Dipietro, L., et al. Changing motor synergies in chronic stroke. Journal of Neurophysiology. 98 (2), 757-768 (2007).
- Dipietro, L., et al. Learning, not adaptation, characterizes stroke motor recovery: evidence from kinematic changes induced by robot-assisted therapy in trained and untrained task in the same workspace. IEEE Trans Neural Syst Rehabil Eng. 20 (1), 48-57 (2012).
- Bosecker, C., Dipietro, L., Volpe, B., Krebs, H. I. Kinematic robot-based evaluation scales and clinical counterparts to measure upper limb motor performance in patients with chronic stroke. Neurorehabilitation and Neural Repair. 24 (1), 62-69 (2010).
- Krebs, H. I., et al. Robotic measurement of arm movements after stroke establishes biomarkers of motor recovery. Stroke. 45 (1), 200-204 (2014).
- Volpe, B. T., et al. Robotic devices as therapeutic and diagnostic tools for stroke recovery. Archives of Neurology. 66 (9), 1086-1090 (2009).
- Hogan, N., et al. Motions or muscles? Some behavioral factors underlying robotic assistance of motor recovery. Journal of Rehabilitation Research and Development. 43 (5), 605-618 (2006).
- Shadmehr, R., Wise, S. P. . The Computational Neurobiology of Reaching and Pointing: A Foundation for Motor Learning. , (2005).
- Dipietro, L., Poizner, H., Krebs, H. I. Spatiotemporal dynamics of online motor correction processing revealed by high-density electroencephalography. J Cogn Neurosci. 26 (9), 1966-1980 (2014).
- Krebs, H., et al. Rehabilitation robotics: Performance-based progressive robot-assisted therapy. Autonomous Robots. 15, 7-20 (2003).
- Colombo, G., Joerg, M., Schreier, R., Dietz, V. Treadmill training of paraplegic patients using a robotic orthosis. Journal of Rehabilitation Research and Development. 37 (6), 693-700 (2000).
- Girone, M., et al. A Stewart platform-based system for ankle telerehabilitation. Autonomous Robots. 10, 203-212 (2001).
- Saglia, J. A., Tsagarakis, N. G., Dai, J. S., Caldwell, D. G. A high-performance redundantly actuated parallel mechanism for ankle rehabilitation. The International Journal of Robotics Research. 28 (9), 1216-1227 (2009).
- Yoon, J., Ryu, J. A novel reconfigurable ankle/foot rehabilitation robot. , 2290-2295 (2005).
- Ruthenberg, B. J., Wasylewski, N. A., Beard, J. E. An experimental device for investigating the force and power requirements of a powered gait orthosis. Journal of Rehabilitation Research and Development. 34 (2), 203-213 (1997).
- Forrester, L. W., et al. Clinical application of a modular ankle robot for stroke rehabilitation. NeuroRehabilitation. 33 (1), 85-97 (2013).
- Díaz, I., Gil, J. J., Sánchez, E. Lower-limb robotic rehabilitation: Literature review and challenges. Journal of Robotics. 2011, 759764 (2011).
- Zhang, X., Yue, Z., Wang, J. Robotics in lower-limb rehabilitation after stroke. Behavioural Neurology. 2017, 3731802 (2017).
- Zhang, M., Davies, T. C., Xie, S. Effectiveness of robot-assisted therapy on ankle rehabilitation – a systematic review. Journal of NeuroEngineering and Rehabilitation. 10, 30 (2013).
- Lo, K., Stephenson, M., Lockwood, C. Effectiveness of robotic assisted rehabilitation for mobility and functional ability in adult stroke patients: a systematic review protocol. JBI Database of Systematic Reviews and Implementation Reports. 15 (1), 39-48 (2017).
- Belda-Lois, J. M., et al. Rehabilitation of gait after stroke: a review towards a top-down approach. Journal of NeuroEngineering and Rehabilitation. 8, 66 (2011).
- Bortole, M., et al. The H2 robotic exoskeleton for gait rehabilitation after stroke: early findings from a clinical study. Journal of NeuroEngineering and Rehabilitation. 12, 54 (2015).
- Banala, S. K., Kim, S. H., Agrawal, S. K., Scholz, J. P. Robot assisted gait training with active leg exoskeleton (ALEX). IEEE Transactions on Neural Systems and Rehabilitation Engineering. 17 (1), 2-8 (2009).
- Bartenbach, V., Wyss, D., Seuret, D., Riener, R. A lower limb exoskeleton research platform to investigate human-robot interaction. 2015 IEEE International Conference on Rehabilitation Robotics (ICORR). 2015, 600-605 (2015).
- Hinkle, J. L., et al. Poststroke fatigue: Emerging evidence and approaches to management: A scientific statement for healthcare professionals from the American heart association. Stroke. 48 (7), e159-e170 (2017).
- Balardin, J. B., Zimeo Morais, G. A., Furucho, R. A., Trambaiolli, L. R., Sato, J. R. Impact of communicative head movements on the quality of functional near-infrared spectroscopy signals: negligible effects for affirmative and negative gestures and consistent artifacts related to raising eyebrows. Journal of Biomedical Optics. 22 (4), 4601 (2017).
- Nazeer, H., Naseer, N., Mehboob, A., Khan, M. J., Khan, R. A., Khan, U. S., Ayaz, Y. Enhancing classification performance of fNIRS-BCI by identifying cortically active channels using the z-score method. Sensors. 20 (23), 6995 (2020).
- Ayaz, H., et al. Optical imaging and spectroscopy for the study of the human brain: status report. Neurophotonics. 9, S24001 (2022).
- Chen, W. L., et al. Functional near-infrared spectroscopy and its clinical application in the field of neuroscience: Advances and future directions. Frontiers in Neuroscience. 14, 724 (2020).
- Yamamoto, K., Miyata, T., Onozuka, A., Koyama, H., Ohtsu, H., Nagawa, H. Plantar flexion as an alternative to treadmill exercise for evaluating patients with intermittent claudication. European Journal of Vascular and Endovascular Surgery. 33 (3), 325-329 (2007).
- Formenti, D., et al. Effects of knee extension with different speeds of movement on muscle and cerebral oxygenation. PeerJ. 6, 5704 (2018).
- Miyai, I., et al. Cortical mapping of gait in humans: a near-infrared spectroscopic topography study. NeuroImage. 14 (5), 1186-1192 (2001).
- Miyai, I., et al. Premotor cortex is involved in restoration of gait in stroke. Annals of Neurology. 52 (2), 188-194 (2002).
- Mihara, M., et al. Sustained prefrontal activation during ataxic gait: a compensatory mechanism for ataxic stroke?. NeuroImage. 37 (4), 1338-1345 (2007).
- Rea, M., et al. Lower limb movement preparation in chronic stroke: A pilot study toward an fNIRS-BCI for gait rehabilitation. Neurorehabilitation and Neural Repair. 28 (6), 564-575 (2014).
- Holtzer, R., Verghese, J., Allali, G., Izzetoglu, M., Wang, C., Mahoney, J. R. Neurological gait abnormalities moderate the functional brain signature of the posture first hypothesis. Brain Topography. 29 (2), 334-343 (2016).
- Kim, H. Y., Yang, S. P., Park, G. L., Kim, E. J., You, J. S. Best facilitated cortical activation during different stepping, treadmill, and robot-assisted walking training paradigms and speeds: A functional near-infrared spectroscopy neuroimaging study. NeuroRehabilitation. 38 (2), 171-178 (2016).
- Khan, H., Nazeer, H., Engell, H., Naseer, N., Korostynska, O., Mirtaheri, P. Prefrontal cortex activation measured during different footwear and ground conditions using fNIRS-A case study. 2021 IEEE International Conference on Artificial Intelligence and Mechatronics Systems (AIMS). , 1-6 (2021).
- Lin, P. Y., Chen, J. J., Lin, S. I. The cortical control of cycling exercise in stroke patients: an fNIRS study). Human Brain Mapping. 34 (10), 2381-2390 (2013).
- Yang, M., Yang, Z., Yuan, T., Feng, W., Wang, P. A systemic review of functional near-infrared spectroscopy for stroke: Current application and future directions. Frontiers in Neurology. 10, 58 (2019).
- Berger, A., Horst, F., Müller, S., Steinberg, F., Doppelmayr, M. Current state and future prospects of EEG and fNIRS in robot-assisted gait rehabilitation: A brief review. Frontiers in Human Neuroscience. 13, 172 (2019).
- Khan, R. A., Naseer, N., Qureshi, N. K., et al. fNIRS-based Neurorobotic Interface for gait rehabilitation. J NeuroEngineering Rehabil. 15 (1), 7 (2018).
- Khan, H., Naseer, N., Yazidi, A., Eide, P. K., Hassan, H. W., Mirtaheri, P. Analysis of Human Gait Using Hybrid EEG-fNIRS-Based BCI System: A Review. Front. Hum. Neurosci. 14, (2020).
- Delpy, D. T., Cope, M. Quantification in tissue near-infrared spectroscopy. Philosophical Transactions of the Royal Society B: Biological Sciences. 352 (1354), 649-659 (1997).
- Huppert, T. J. Commentary on the statistical properties of noise and its implication on general linear models in functional near-infrared spectroscopy. Neurophotonics. 3, 010401 (2016).
- Alexandre, F., Heraud, N., Oliver, N., Varray, A. Cortical implication in lower voluntary muscle force production in non-hypoxemic COPD patients. PLoS One. 9 (6), 100961 (2014).
- Yoon, T., Vanden Noven, M. L., Nielson, K. A., Hunter, S. K. Brain areas associated with force steadiness and intensity during isometric ankle dorsiflexion in men and women. Experimental Brain Research. 232 (10), 3133-3145 (2014).
- Ciccarelli, O., et al. Identifying brain regions for integrative sensorimotor processing with ankle movements. Experimental Brain Research. 166 (1), 31-42 (2005).
- Udina, C., et al. Functional near-infrared spectroscopy to study cerebral hemodynamics in older adults during cognitive and motor tasks: A review. Frontiers in Aging Neuroscience. 11, 367 (2020).
- Thickbroom, G. W., Phillips, B. A., Morris, I., Byrnes, M. L., Mastaglia, F. L. Isometric force-related activity in sensorimotor cortex measured with functional MRI. Experimental Brain Research. 121 (1), 59-64 (1998).
- Derosière, G., Alexandre, F., Bourdillon, N., Mandrick, K., Ward, T. E., Perrey, S. Similar scaling of contralateral and ipsilateral cortical responses during graded unimanual force generation. NeuroImage. 85 (1), 471-477 (2014).
- Shi, P., Li, A., Yu, H. Response of the cerebral cortex to resistance and non-resistance exercise under different trajectories: A functional near-infrared spectroscopy study. Frontiers in Neuroscience. 15, 685920 (2021).
- Dettmers, C., et al. Relation between cerebral activity and force in the motor areas of the human brain. Journal of Neurophysiology. 74 (2), 802-815 (1995).
- Keisker, B., Hepp-Reymond, M. C., Blickenstorfer, A., Kollias, S. S. Differential representation of dynamic and static power grip force in the sensorimotor network. The European Journal of Neuroscience. 31 (8), 1483-1491 (2010).
- Harada, T., Miyai, I., Suzuki, M., Kubota, K. Gait capacity affects cortical activation patterns related to speed control in the elderly. Experimental Brain Research. 193 (3), 445-454 (2009).
- Saleh, S., et al. The role of premotor areas in dual tasking in healthy controls and persons with multiple sclerosis: An fNIRS imaging study. Frontiers in Behavioral Neuroscience. 12, 296 (2018).
- Bonnal, J., et al. Relation between cortical activation and effort during robot-mediated walking in healthy people: A functional near-infrared spectroscopy neuroimaging study (fNIRS). Sensors. 22 (15), 5542 (2022).
- Shibuya, K., Sadamoto, T., Sato, K., Moriyama, M., Iwadate, M. Quantification of delayed oxygenation in ipsilateral primary motor cortex compared with contralateral side during a unimanual dominant-hand motor task using near-infrared spectroscopy. Brain Research. 1210, 142-147 (2008).
- Dai, T. H., Liu, J. Z., Sahgal, V., Brown, R. W., Yue, G. W. Relationship between muscle output and functional MRI-measured brain activation. Experimental brain research. 140 (3), 290-300 (2001).
- Cabibel, V., Hordacre, B., Perrey, S. Implication of the ipsilateral motor network in unilateral voluntary muscle contraction: the cross-activation phenomenon. Journal of Neurophysiology. 123 (5), 2090-2098 (2020).
- Akselrod, M., Martuzzi, R., Serino, A., vander Zwaag, W., Gassert, R., Blanke, O. Anatomical and functional properties of the foot and leg representation in areas 3b, 1 and 2 of primary somatosensory cortex in humans: A 7T fMRI study. NeuroImage. 159, 473-487 (2017).
- Brigadoi, S., Cooper, R. J. How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics. 2 (2), 025005 (2015).
- Funahashi, S. Prefrontal contribution to decision-making under free-choice conditions. Frontiers in Neuroscience. 11, 431 (2017).
- Simon, S. R., Meunier, M., Piettre, L., Berardi, A. M., Segebarth, C. M., Boussaoud, D. Spatial attention and memory versus motor preparation: premotor cortex involvement as revealed by fMRI. Journal of Neurophysiology. 88 (4), 2047-2057 (2002).
- Desmurget, M., Sirigu, A. A parietal-premotor network for movement intention and motor awareness. Trends in Cognitive Sciences. 13 (10), 411-419 (2009).
- Nachev, P., Kennard, C., Husain, M. Functional role of the supplementary and pre-supplementary motor areas. Nature reviews. Neuroscience. 9 (11), 856-869 (2008).
- Thoenissen, D., Zilles, K., Toni, I. Differential involvement of parietal and precentral regions in movement preparation and motor intention. The Journal of neuroscience: the official journal of the Society for Neuroscience. 22 (20), 9024-9034 (2002).
- Al-Quraishi, M. S., Elamvazuthi, I., Tang, T. B., Al-Qurishi, M., Adil, S. H., Ebrahim, M. Bimodal data fusion of simultaneous measurements of EEG and fNIRS during lower limb movements. Brain Sciences. 11 (6), 713 (2021).
- Bishnoi, A., Holtzer, R., Hernandez, M. E. Brain Activation Changes While Walking in Adults with and without Neurological Disease: Systematic Review and Meta-Analysis of Functional Near-Infrared Spectroscopy Studies. Brain sciences. 11 (3), 291 (2021).
- Oh, S., Song, M., Kim, J. Validating attentive locomotion training using interactive treadmill: an fNIRS study. Journal of NeuroEngineering and Rehabilitation. 15 (1), 122 (2018).

