T7 RNA פולימראז בתיווך Multigene הביטוי מערכת, pMGX
Summary
מחקר זה מתאר שיטות עבור T7 בתיווך ביטוי משותף של גנים מרובים מ פלסמיד בודד ב Escherichia coli באמצעות מערכת pMGX פלסמיד.
Abstract
ביטוי משותף של חלבונים מרובים הוא חיוני יותר ויותר עבור ביולוגיה סינתטית, חקר קומפלקסים חלבונים חלבון, אפיון ורתום מסלולים biosynthetic. בכתב יד זה, את השימוש של מערכת יעילה מאוד לבניית multonene סינתטי אופרנים תחת שליטה של פולימרז T7 RNA inducable מתואר. מערכת זו מאפשרת גנים רבים להתבטא בו זמנית פלסמיד אחד. הנה, קבוצה של ארבעה וקטורים הקשורים, pMGX-A, pMGX-hea, pMGX-K, ו pMGX-hek, עם או ampicillin או קנמיצין התנגדות סמן לבחירה (A ו K) או גם בעל או חסר N- מסוף hexahistidine התג (שלו) נחשפים. פרוטוקולים מפורטים לבניית אופטונים סינתטיים באמצעות מערכת וקטורית זו מסופקים יחד עם הנתונים המתאימים, מראים כי מערכת pMGX מבוסס המכיל חמישה גנים ניתן לבנות בקלות ומשמש לייצר את כל חמש חלבונים מקודדים ב Escherichia coli . זה systEm ופרוטוקול מאפשר לחוקרים באופן שגרתי להביע מורכבים מרובי רכיב רכיבים ומסלולים ב E. coli .
Introduction
ביטוי משותף של חלבונים מרובים הוא חיוני יותר ויותר, במיוחד ביישומים ביולוגיה סינתטית, שבו מודולים פונקציונליים מרובים חייב לבוא לידי ביטוי 1 ; בחקר חלבונים חלבונים, שבו הביטוי ואת הפונקציה דורשים לעתים קרובות שיתוף ביטוי 2 , 3 ; וכן אפיון ורתום מסלולים ביוסינתטיים, שבו כל גן במסלול חייב לבוא לידי ביטוי 4 , 5 , 6 , 7 , 8 . מספר מערכות פותחו עבור שיתוף ביטוי, במיוחד האורגניזם המארח Escherichia coli , סוס העבודה עבור ביטוי חלבון רקומביננטי מעבדה 9 . לדוגמה, פלסמידים מרובים עם סמנים לבחירה שונים ניתן להשתמש כדי לבטא חלבונים בודדים באמצעות שפע של שונים לשעבר 12 הצ 12 , 12 . מערכות פלסמיד יחיד עבור ביטוי חלבון מרובים השתמשו גם מספר האמרגן לשלוט על הביטוי של כל גן 10 , 12 ; אופטונים סינתטיים, שבהם מקודדים גנים מרובים על תמליל יחיד 2 , 13 ; או, במקרים מסוימים, גן יחיד קידוד פוליפפטיד כי הוא מעובד proteolytically בסופו של דבר, מניב את החלבונים הרצוי של עניין 14 .
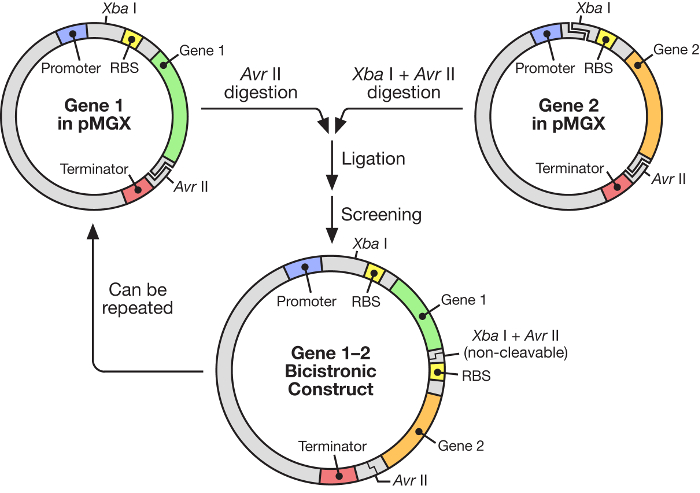
איור 1: זרימת עבודה pMGX מראה את הבנייה של וקטור polycistronic. מערכת pMGX מספקת אסטרטגיה גמישה וקלה לשימוש לבניית אופרונים סינתטיים בשליטתו של מקדם T7."לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו." Target = "_ blank"
בכתב יד זה, את השימוש של מערכת יעילה מאוד לבניית multonene אופטונים סינתטיים תחת שליטה של פולימרז T7 RNA inducible ( איור 1 ) מתואר. מערכת זו מאפשרת גנים רבים להתבטא בו זמנית פלסמיד אחד. הוא מבוסס על מערכת פלסמיד, שנקרא במקור pKH22, כי כבר בשימוש בהצלחה עבור מספר יישומים שונים 6 , 7 , 8 . הנה, זה להגדיר פלסמיד מורחבת לכלול ארבעה וקטורים הקשורים: pMGX-A, וקטור ביטוי חסר כל C- או N- מסוף תגים עם סמן עמיד ampicillin; PMGX-heA, ביטוי וקטור קידוד תג N- מסוף hexahistidine ועם סמן עמיד ampicillin; PMGX-K, וקטור ביטוי lAcking כל C או N- מסוף תגים עם סמן התנגדות kanamycin; ו pMGX-hek, ביטוי וקטור קידוד N- מסוף hexahistidine תג עם סמן התנגדות kanamycin. במחקר זה, השיטה להפקת וקטור polycistronic המכיל חמישה גנים באמצעות מערכת pMGX, במיוחד pMGX-A, הוא הפגינו יחד עם הייצור המוצלח של כל חלבון הפרט Escherichia coli .
Protocol
Representative Results
Discussion
ביטוי משותף של גנים מרובים הוא חיוני יותר ויותר, במיוחד באפיון מחדש מסלולים מורכבים, multigene מטבולי 3 , 4 , 5 . מערכת pMGX עושה ביטוי multigene שיתוף ב E. קולי שגרת 6 , 7 , 8 ונגי…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מדעי הטבע והנדסה מועצת המחקר של קנדה.
Materials
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50 x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm X 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box – PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
Riferimenti
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -. J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp Available from: https://www.jove.com/science-education/5074/molecular-cloning (2016)
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp Available from: https://www.jove.com/science-education/5065/the-western-blot (2016)
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).

