유도 성 T7 RNA 중합 효소 매개 멀티젠 발현 시스템, pMGX
Summary
이 연구는 pMGX 플라스미드 시스템을 사용하여 대장균 에서 단일 플라스미드로부터 다중 유전자의 T7 매개 공동 – 발현을위한 방법을 기술한다.
Abstract
여러 단백질의 동시 발현은 합성 생물학, 단백질 – 단백질 복합체 연구, 생합성 경로 규명 및 활용에 점점 더 필수적입니다. 이 원고에서, 유도 성 T7 RNA 중합 효소의 조절하에 multigene 합성 오페론의 건설을위한 매우 효과적인 시스템의 사용이 설명된다. 이 시스템은 많은 유전자가 한 플라스미드에서 동시에 발현되도록합니다. 여기서, 암피실린 또는 카나마이신 내성 선택 마커 (A 및 K) 및 N 말단 헥사 히스티딘을 보유하거나 보유하지 않은 4 개의 관련된 벡터, pMGX-A, pMGX-hisA, pMGX-K 및 pMGX-hisK의 세트 태그 (his)가 공개됩니다. 이 벡터 시스템을 이용한 합성 오페론의 구축을위한 상세한 프로토콜은 대응 유전자와 함께 제공되어, 5 개의 유전자를 함유하는 pMGX- 기반 시스템이 용이하게 구축되어 대장균 에서 5 가지 암호화 된 단백질 모두를 생성하는데 사용될 수 있음을 보여준다. 이 시스템em과 프로토콜을 사용하여 연구자는 대장균 에서 복잡한 다중 구성 요소 모듈과 경로를 일상적으로 표현할 수 있습니다.
Introduction
여러 단백질의 동시 발현은 점점 더 필수적이며, 특히 합성 생물학 분야에서 여러 기능적 모듈이 표현되어야한다. 단백질 단백질 복합체를 연구 할 때, 발현과 기능은 흔히 동시 발현 2 , 3을 필요로 한다. 경로의 각 유전자가 4 , 5 , 6 , 7 , 8 로 표현되어야하는 생합성 경로를 특성화하고 활용하는데있다. 실험실 재조합 단백질 발현을위한 작업 말인 대장균 (Escherichia coli) 에서 특히 공동 발현을위한 많은 시스템이 개발되었다. 예를 들어, 선택성 마커가 다른 여러 플라스미드를 사용하여 다양한 다른 ex 압흔 벡터들 ( 10 , 11) . 다중 단백질 발현을위한 단일 플라스미드 시스템은 각 유전자의 발현을 조절하기 위해 다중 프로모터를 사용 하였다. 다수의 유전자가 단일 전사 물에 암호화되어있는 합성 오페론 2 , 13 ; 또는 어떤 경우에는 궁극적으로 단백질 분해 처리 된 폴리 펩타이드를 암호화하는 단일 유전자로 목적하는 목적 단백질을 생성한다.
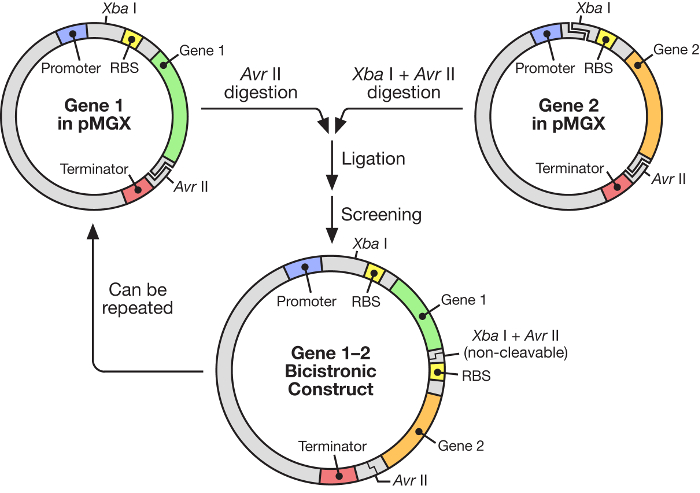
그림 1 : polycistronic vector의 구조를 보여주는 pMGX workflow. pMGX 시스템은 유도 성 T7 프로모터의 제어하에 합성 오페론을 제조하기위한 유연하고 사용하기 쉬운 전략을 제공한다.e.com/files/ftp_upload/55187/55187fig1large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
이 원고에서 유도 성 T7 RNA 중합 효소 ( 그림 1 )의 제어하에 multigene 합성 오페론의 건설을위한 매우 효과적인 시스템의 사용이 설명됩니다. 이 시스템은 많은 유전자가 한 플라스미드에서 동시에 발현되도록합니다. 이것은 원래 pKH22라고 불리는 플라스미드 시스템에 기반을두고 있으며, 여러 가지 다양한 응용 분야에서 성공적으로 사용되고 있습니다. 6 , 7 , 8 . 여기서,이 플라스미드 세트는 4 개의 관련된 벡터, 즉 C- 또는 N- 말단 태그가없는 발현 벡터 인 pMGX-A 및 암피실린 내성 마커를 포함하도록 확대된다. pMGX-hisA, N- 말단 헥사 히스티딘 태그 및 암피실린 내성 마커를 코딩하는 발현 벡터; pMGX-K, 발현 벡터 l임의의 C- 또는 N- 말단 태그 및 카나마이신 내성 마커를 수취하는 단계; 및 N 말단 헥사 히스티딘 태그 및 카나마이신 내성 마커를 코딩하는 발현 벡터 인 pMGX-hisK. 이 연구에서, pMGX 시스템, 특히 pMGX-A를 사용하여 5 개의 유전자를 포함하는 폴리 시스트 론 벡터를 생성하는 방법이 대장균 에서 각각의 개별 단백질의 성공적인 생산과 함께 입증되었다.
Protocol
Representative Results
Discussion
복합 유전자의 동시 발현은 특히 복잡하고 다중 유전자 대사 경로 3 , 4 , 5 를 특성화하고 재구성하는 데 점점 더 필수적입니다. pMGX 시스템은 대장균 루틴 6 , 7 , 8 에서 다중 유전자 동시 발현을 만들고 다양한 연구자가 접근 할 수 있도록한다. 이 연?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 연구는 캐나다의 자연 과학 및 공학 연구위원회 (Natural Science and Engineering Research Council of Canada)의 지원을 받았다.
Materials
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50 x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm X 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box – PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
Riferimenti
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -. J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp Available from: https://www.jove.com/science-education/5074/molecular-cloning (2016)
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp Available from: https://www.jove.com/science-education/5065/the-western-blot (2016)
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).

