التخمير الذي يتم التحكم فيه بالضوء لإنتاج المواد الكيميائية والبروتين الميكروبي
Summary
يوفر التحكم البصري الجيني في التمثيل الغذائي الميكروبي تحكما ديناميكيا مرنا في عمليات التخمير. يوضح البروتوكول هنا كيفية إعداد التخمير المنظم بالضوء الأزرق لإنتاج المواد الكيميائية والبروتين على نطاقات حجمية مختلفة.
Abstract
توفر مصانع الخلايا الميكروبية بديلا مستداما لإنتاج المواد الكيميائية والبروتينات المؤتلفة من المواد الأولية المتجددة. ومع ذلك ، فإن إثقال كاهل الكائنات الحية الدقيقة بالتعديلات الجينية يمكن أن يقلل من لياقة المضيف وإنتاجيته. يمكن التغلب على هذه المشكلة باستخدام التحكم الديناميكي: التعبير المستحث عن الإنزيمات والمسارات ، عادة باستخدام إضافات كيميائية أو مغذية ، لتحقيق التوازن بين النمو الخلوي والإنتاج. يقدم علم البصريات الوراثي طريقة غير غازية وقابلة للتعديل للغاية وقابلة للعكس لتنظيم التعبير الجيني ديناميكيا. هنا ، نصف كيفية إعداد التخمير الذي يتم التحكم فيه بالضوء للإشريكية القولونية الهندسية و Saccharomyces cerevisiae لإنتاج المواد الكيميائية أو البروتينات المؤتلفة. نناقش كيفية تطبيق الضوء في أوقات وجرعات مختارة لفصل النمو الميكروبي والإنتاج لتحسين التحكم في التخمير والإنتاجية ، بالإضافة إلى اعتبارات التحسين الرئيسية للحصول على أفضل النتائج. بالإضافة إلى ذلك ، نصف كيفية تنفيذ عناصر التحكم في الضوء لتجارب المفاعلات الحيوية على نطاق المختبر. تسهل هذه البروتوكولات اعتماد الضوابط البصرية الجينية في الكائنات الحية الدقيقة الهندسية لتحسين أداء التخمير.
Introduction
يقدم علم البصريات الوراثي، وهو التحكم في العمليات البيولوجية باستخدام البروتينات المستجيبة للضوء، استراتيجية جديدة للتحكم ديناميكيا في التخمير الميكروبي لإنتاج المواد الكيميائية والبروتين1،2. غالبا ما يضعف عبء المسارات الأيضية الهندسية وسمية بعض المواد الوسيطة والمنتجات نمو الخلايا3. ويمكن أن تؤدي هذه الضغوط إلى ضعف تراكم الكتلة الأحيائية وانخفاض الإنتاجية3. ويمكن التصدي لهذا التحدي عن طريق تقسيم عمليات التخمير مؤقتا إلى مرحلة نمو وإنتاج، تكرس موارد التمثيل الغذائي لتراكم الكتلة الحيوية أو توليف المنتجات على التوالي4. لقد أظهرنا مؤخرا أن الانتقال من النمو إلى الإنتاج في هذا التخمير ثنائي المراحل يمكن أن يحدث مع التغيرات في ظروف الإضاءة5،6،7. توفر القابلية العالية للضبط والانعكاس والتعامد لمدخلات الضوء8 مزايا فريدة للتخمير الذي يتم التحكم فيه بالضوء والذي يصعب أو يستحيل تكراره مع المحفزات الكيميائية المستخدمة في التحكم الديناميكي في التخمير التقليدي ثنائي الطور4،9،10،11.
تم استخدام بروتين EL222 المستجيب للضوء الأزرق المشتق من Erythrobacter litoralis لتطوير العديد من الدوائر البصرية الجينية للهندسة الأيضية في Saccharomyces cerevisiae5,7,12,13. يحتوي EL222 على مجال مستشعر جهد الضوء والأكسجين (LOV) الذي يخضع لتحول توافقي عند تنشيط الضوء الأزرق (465 نانومتر) ، مما يسمح له بالارتباط بتسلسل الحمض النووي المتشابه (C120)13. يؤدي دمج EL222 مع مجال تنشيط VP16 الفيروسي (VP16-EL222) إلى عامل نسخ مستجيب للضوء الأزرق يمكنه تنشيط التعبير الجيني بشكل عكسي في S. cerevisiae7 والكائنات الحية الأخرى14 من المروج الاصطناعي PC120. تم تطوير العديد من الدوائر القائمة على EL222 واستخدامها للإنتاج الكيميائي في S. cerevisiae ، مثل نظام OptoEXP الأساسي المنشط بالضوء 7 ، حيث يتم التعبير عن الجين محل الاهتمام مباشرة من PC120 (الشكل 1A). ومع ذلك ، فإن المخاوف من اختراق الضوء في كثافات الخلايا العالية التي تصادف عادة في مرحلة إنتاج التخمير حفزتنا على تطوير دوائر مقلوبة يتم تحفيزها في الظلام ، مثل دوائر OptoINVRT و OptoQ-INVRT (الشكل 1B) 5،7،13. تسخر هذه الأنظمة الجالاكتوز (GAL) أو حمض الكينيك (Q) من S. cerevisiae و N. crassa ، على التوالي ، وتتحكم في مثبطاتها المقابلة (GAL80 و QS) باستخدام VP16-EL222 ، لقمع التعبير الجيني في الضوء وحثه بقوة في الظلام. يؤدي الجمع بين دوائر OptoEXP و OptoINVRT إلى التحكم ثنائي الاتجاه في التعبير الجيني ، مما يتيح التخمير ثنائي الطور الذي يتم فيه تحفيز مرحلة النمو بالضوء الأزرق ، ومرحلة الإنتاج مع الظلام (الشكل 2A)5,7.
إن استخدام الضوء بدلا من الظلام للحث على التعبير الجيني خلال مرحلة الإنتاج من شأنه أن يوسع بشكل كبير قدرات الضوابط البصرية الجينية ولكنه سيتطلب أيضا التغلب على قيود اختراق الضوء لكثافات الخلايا العالية التي تصادف عادة في مرحلة التخمير هذه. وتحقيقا لهذه الغاية، قمنا بتطوير دوائر، تعرف باسم OptoAMP و OptoQ-AMP، تعمل على تضخيم الاستجابة النسخية لتحفيز الضوء الأزرق. تستخدم هذه الدوائر طفرات من النوع البري أو شديد الحساسية من VP16-EL222 للتحكم في إنتاج منشطات النسخ Gal4p أو QF2 من تنظيمات GAL أو Q ، على التوالي ، مما يحقق حساسية معززة وتعبيرا جينيا أقوى مع الضوء12,13 (الشكل 1C). يمكن لدوائر OptoAMP تحقيق تحريض ضوئي كامل ومتجانس في مفاعلات حيوية سعة 5 لتر بكثافة بصرية (تقاس عند 600 نانومتر; OD600) قيم لا تقل عن 40 مع ~ 0.35٪ فقط من الإضاءة (5٪ جرعة ضوئية على ~ 7٪ فقط من السطح السائب). وهذا يدل على درجة أعلى من الحساسية مقارنة ب OptoEXP، الذي يتطلب إضاءة بنسبة 100٪ تقريبا12. إن القدرة على تحفيز التعبير الجيني بفعالية مع الضوء عند كثافة الخلايا العالية تفتح فرصا جديدة للتحكم الديناميكي في عمليات التخمير. ويشمل ذلك عمليات التخمير التشغيلية في أكثر من مرحلتين زمنيتين، مثل التخمير ثلاثي المراحل، حيث يتم إنشاء مراحل النمو والحث والإنتاج بجداول إضاءة فريدة لتحسين الإنتاج الكيميائي (الشكل 2B)12.
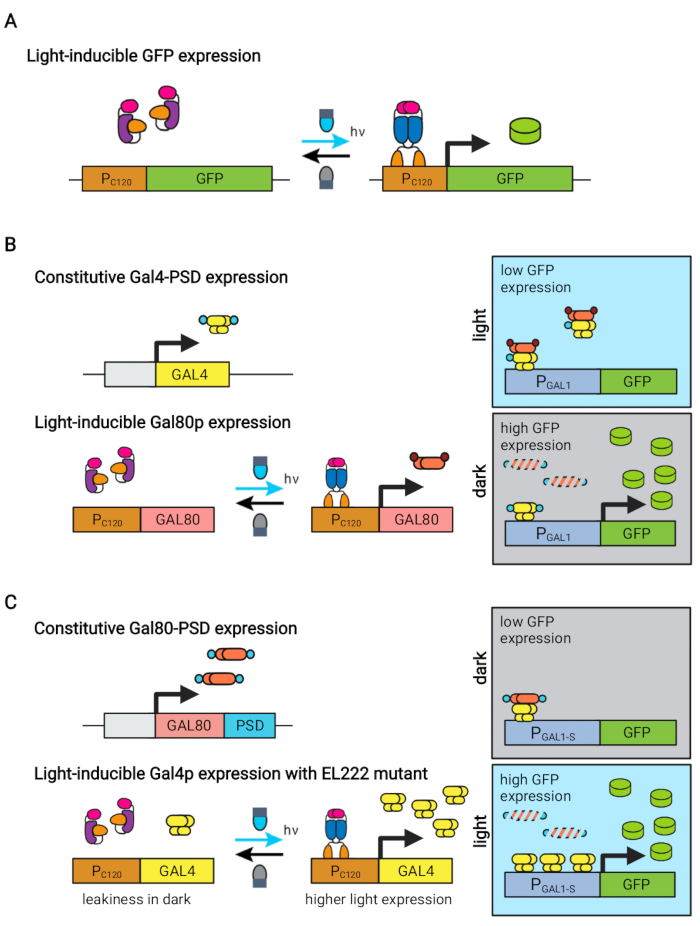
الشكل 1: الدوائر البصرية الجينية للتحكم الديناميكي في S. cerevisiae. تعتمد دوائر OptoEXP و OptoINVRT و OptoAMP على نظام VP16-EL222 الحساس للضوء. (أ) في دائرة OptoEXP ، يؤدي التعرض للضوء الأزرق إلى تغيير توافقي و dimerization من VP16-EL222 ، مما يكشف عن مجال ربط الحمض النووي ويسمح بالنسخ من PC120. وقد عدل هذا الرقم من تشاو وآخرين.7. (B) تسخر دوائر OptoINVRT تنظيمات GAL (المعروضة) أو Q للحث على التعبير في الظلام. في الدوائر القائمة على GAL، يتم التعبير عن VP16-EL222 وGAL4 بشكل تأسيسي، في حين يتم التعبير عن محركات الأقراص PC120 عن مثبط GAL80 (في الدوائر القائمة على Q، يتم استبدال GAL4 وGAL80 ب QF2 و QS، على التوالي، ويتم استخدام مروج اصطناعي يحتوي على QUAS بدلا من مروج GAL). في الضوء ، يمنع Gal80p تنشيط الجين محل الاهتمام من PGAL1. في الظلام ، لا يتم التعبير عن GAL80 ويتحلل بسرعة عن طريق دمجه في مجال degron التأسيسي (المجال البني الصغير) ، والذي يسمح بتنشيط PGAL1 بواسطة Gal4p. وقد عدل هذا الرقم من Zhao et al.5. (C) تستخدم دوائر OptoAMP أيضا VP16-EL222 للتحكم في تنظيمات GAL (المعروضة) أو Q. في هذه الدوائر ، يتم التعبير عن مثبط GAL80 (أو QS) بشكل أساسي ودمجه في degron حساس للصور (مجال أزرق صغير) يضمن القمع المحكم في الظلام. PC120 وتعبير التحكم المتحور VP16-EL222 شديد الحساسية ل GAL4 (أو QF2) مع الضوء ، والذي ينشط بقوة PGAL1 (أو مروج يحتوي على QUAS) في الضوء. يمكن للدوائر المشتقة من GAL استخدام أشكال هندسية من PGAL1 ، مثل PGAL1-M أو PGAL1-S ، والتي زادت من النشاط ، بالإضافة إلى المروجين من النوع البري الذي يتحكم فيه تنظيم GAL (PGAL1 ، PGAL10 ، PGAL2 ، PGAL7). تم تعديل الرقم من Zhao et al.12. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
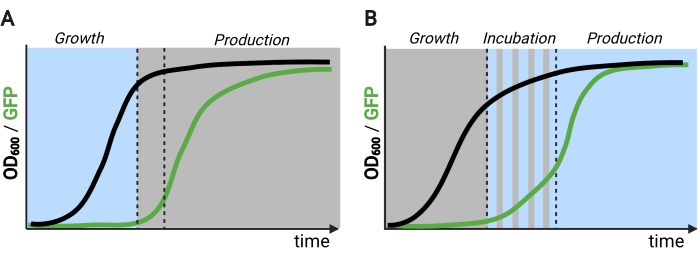
الشكل 2: التخمير ثنائي وثلاثي الطور عبر الزمن. (أ) تتكون عمليات التخمير ثنائية الطور التي تعمل بدوائر مقلوبة من مرحلة نمو مدفوعة بالضوء ومرحلة إنتاج مظلمة. في مرحلة النمو ، تتراكم الكتلة الحيوية مع بقاء مسار الإنتاج مكبوتا. عند الوصول إلى OD600 المطلوب ، يتم نقل الخلايا إلى الظلام لضبط التمثيل الغذائي قبل إعادة تعليقها في وسائط جديدة لمرحلة الإنتاج. (ب) في عملية من ثلاث مراحل ، يتم تحديد مراحل النمو والحضانة والإنتاج من خلال جداول ضوئية فريدة من نوعها ، والتي قد تتكون من فترة نمو مظلمة ، وحضانة نبضية ، ومرحلة إنتاج مضاءة بالكامل. الشكل الذي تم إنشاؤه باستخدام Biorender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
كما تم تطوير الدوائر البصرية الجينية للتحكم الديناميكي في إنتاج المواد الكيميائية والبروتين في الإشريكية القولونية. تتحكم دوائر OptoLAC في مثبط LacI البكتيري باستخدام دائرة pDawn المستجيبة للضوء ، والتي تستند إلى نظام YF1 / FixJ المكون من مكونين 6 (الشكل 3). على غرار OptoINVRT5 ، تم تصميم دوائر OptoLAC لقمع التعبير الجيني في الضوء وتحفيزه في الظلام. يمكن أن تتطابق مستويات التعبير باستخدام دوائر OptoLAC مع تلك التي تحققت باستخدام تحريض الأيزوبروبيل القياسي β-d-1-thiogalactopyranoside (IPTG) ، وبالتالي الحفاظ على قوة الحث الكيميائي مع توفير إمكانية محسنة للضبط والانعكاس 6. لذلك ، تتيح دوائر OptoLAC التحكم الفعال في البصريات الجينية للهندسة الأيضية في الإشريكية القولونية.
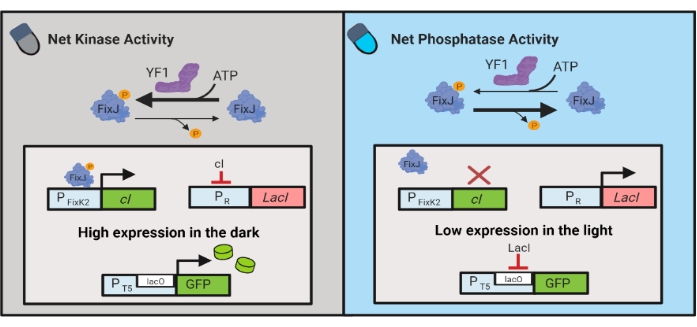
الشكل 3: دوائر OptoLAC للتحكم الديناميكي في الإشريكية القولونية. تقوم دوائر OptoLAC بتكييف نظام pDawn و lac operon لتحقيق التنشيط في الظلام والقمع في الضوء. في الظلام ، يفسفرات YF1 FixJ ، والتي تقوم بعد ذلك بتنشيط مروج PFixK2 للتعبير عن مثبط cI. يمنع مثبط cI التعبير عن مثبط lacI من مروج PR ، مما يسمح بنسخ الجين محل الاهتمام من مروج يحتوي على lacO. على العكس من ذلك ، يقلل الضوء الأزرق من نشاط كيناز صافي YF1 ، مما يعكس فسفرة FixJ وبالتالي تعبير cI ، مما يقلل من التعبير عن lacI ويمنع التعبير من المروج المحتوي على lacO. وقد عدل هذا الرقم من لالواني وآخرين.6. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نصف هنا البروتوكولات الأساسية للتخمير الذي يتم التحكم فيه بالضوء ل S. cerevisiae و E. coli لإنتاج المواد الكيميائية أو البروتين. بالنسبة لكل من الخميرة والبكتيريا ، نركز أولا على التخمير مع مرحلة نمو مدفوعة بالضوء ومرحلة إنتاج ناجمة عن الظلام ممكنة بواسطة دوائر OptoINVRT و OptoLAC. بعد ذلك ، نصف بروتوكولا للتخمير ثلاثي المراحل (النمو ، الحث ، الإنتاج) الذي يتم التحكم فيه بالضوء والذي يتم تمكينه بواسطة دوائر OptoAMP. علاوة على ذلك ، نصف كيفية توسيع نطاق التخمير الذي يتم التحكم فيه بصريا من الصفائح الدقيقة إلى المفاعلات الحيوية على نطاق المختبر. من خلال هذا البروتوكول ، نهدف إلى توفير دليل كامل وقابل للتكرار بسهولة لإجراء عمليات التخمير التي يتم التحكم فيها بالضوء لإنتاج المواد الكيميائية أو البروتين.
Protocol
Representative Results
Discussion
لطالما تم تطبيق التحكم الديناميكي لتحسين إنتاجية الهندسة الأيضية وإنتاج البروتين المؤتلف4. عادة ما يتم تنفيذ التحولات في التعبير الأنزيمي باستخدام محفزات كيميائية مثل IPTG21 و galactose22 و tetracycline23 ، ولكن تم أيضا بوساطة استخدام ظروف العملية مثل درجة الحرار…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا البحث من قبل وزارة الطاقة الأمريكية ، ومكتب العلوم ، ومكتب البحوث البيولوجية والبيئية رقم الجائزة DE-SC0019363 ، وجائزة NSF CAREER CBET-1751840 ، وصناديق بيو الخيرية ، وجائزة كاميل دريفوس للمعلمين والباحثين.
Materials
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Riferimenti
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioingegneria. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).

