माइक्रोबियल रासायनिक और प्रोटीन उत्पादन के लिए प्रकाश-नियंत्रित किण्वन
Summary
माइक्रोबियल चयापचय का ऑप्टोजेनेटिक नियंत्रण किण्वन प्रक्रियाओं पर लचीला गतिशील नियंत्रण प्रदान करता है। यहां प्रोटोकॉल से पता चलता है कि विभिन्न वॉल्यूमेट्रिक पैमाने पर रासायनिक और प्रोटीन उत्पादन के लिए नीले प्रकाश-विनियमित किण्वन कैसे स्थापित किए जाएं।
Abstract
माइक्रोबियल सेल कारखानों नवीकरणीय feedstocks से रसायनों और पुनः संयोजक प्रोटीन के उत्पादन के लिए एक स्थायी विकल्प प्रदान करते हैं। हालांकि, आनुवांशिक संशोधनों के साथ एक सूक्ष्मजीव पर अधिक बोझ डालना मेजबान फिटनेस और उत्पादकता को कम कर सकता है। इस समस्या को गतिशील नियंत्रण का उपयोग करके दूर किया जा सकता है: एंजाइमों और मार्गों की अपरिवर्तनीय अभिव्यक्ति, आमतौर पर सेलुलर विकास और उत्पादन को संतुलित करने के लिए रासायनिक या पोषक तत्व-आधारित एडिटिव्स का उपयोग करके। ऑप्टोजेनेटिक्स जीन अभिव्यक्ति को गतिशील रूप से विनियमित करने की एक गैर-आक्रामक, अत्यधिक ट्यूनेबल और प्रतिवर्ती विधि प्रदान करता है। यहां, हम वर्णन करते हैं कि रसायनों या पुनः संयोजक प्रोटीन के उत्पादन के लिए इंजीनियर एस्चेरिचिया कोलाई और Saccharomyces cerevisiae के प्रकाश-नियंत्रित किण्वन को कैसे स्थापित किया जाए। हम चर्चा करते हैं कि चयनित समय पर प्रकाश कैसे लागू किया जाए और बेहतर किण्वन नियंत्रण और उत्पादकता के लिए माइक्रोबियल विकास और उत्पादन को कम करने के लिए खुराक, साथ ही साथ सर्वोत्तम परिणामों के लिए प्रमुख अनुकूलन विचार। इसके अतिरिक्त, हम वर्णन करते हैं कि प्रयोगशाला-पैमाने पर बायोरिएक्टर प्रयोगों के लिए प्रकाश नियंत्रण को कैसे लागू किया जाए। ये प्रोटोकॉल बेहतर किण्वन प्रदर्शन के लिए इंजीनियर सूक्ष्मजीवों में ऑप्टोजेनेटिक नियंत्रण को अपनाने की सुविधा प्रदान करते हैं।
Introduction
ऑप्टोजेनेटिक्स, प्रकाश-उत्तरदायी प्रोटीन के साथ जैविक प्रक्रियाओं का नियंत्रण, रासायनिक और प्रोटीन उत्पादन के लिए गतिशील रूप से माइक्रोबियल किण्वन को नियंत्रित करने के लिए एक नई रणनीति प्रदान करता है1,2। इंजीनियर चयापचय मार्गों का बोझ और कुछ मध्यवर्ती और उत्पादों की विषाक्तता अक्सर सेल विकास को बाधित करती है3। इस तरह के तनाव खराब बायोमास संचय और कम उत्पादकता 3 को जन्म दे सकते हैं। इस चुनौती को अस्थायी रूप से किण्वन को विकास और उत्पादन चरण में विभाजित करके संबोधित किया जा सकता है, जो क्रमशः बायोमास संचय या उत्पाद संश्लेषण के लिए चयापचय संसाधनों को समर्पित करते हैं। हमने हाल ही में दिखाया है कि इस दो-चरण किण्वन में विकास से उत्पादन के लिए संक्रमण को रोशनी की स्थिति में परिवर्तन के साथ प्रेरित किया जा सकता है5,6,7। प्रकाश इनपुट 8 की उच्च tunability, उत्क्रमण, और orthogonality प्रकाश-नियंत्रित किण्वन के लिए अद्वितीय लाभ प्रदान करते हैं जो पारंपरिक दो-चरण किण्वन4,9,10,11 के गतिशील नियंत्रण में उपयोग किए जाने वाले रासायनिक प्रेरकों के साथ दोहराने के लिए मुश्किल या असंभव हैं।
एरिथ्रोबैक्टर लिटोरलिस से व्युत्पन्न नीले प्रकाश उत्तरदायी EL222 प्रोटीन का उपयोग Saccharomyces cerevisiae5,7,12,13 में चयापचय इंजीनियरिंग के लिए कई ऑप्टोजेनेटिक सर्किट विकसित करने के लिए किया गया है। EL222 में एक प्रकाश-ऑक्सीजन-वोल्टेज सेंसर (LOV) डोमेन होता है जो नीले प्रकाश सक्रियण (465 एनएम) पर एक संरचनात्मक बदलाव से गुजरता है, जो इसे अपने संज्ञेय डीएनए अनुक्रम (C120)13 को बांधने की अनुमति देता है। वायरल VP16 सक्रियण डोमेन (VP16-EL222) के लिए EL222 फ्यूजिंग एक नीले प्रकाश उत्तरदायी प्रतिलेखन कारक है कि प्रतिवर्ती सिंथेटिक प्रमोटर PC120 से S. cerevisiae7 और अन्य जीवों 14 में जीन अभिव्यक्ति को सक्रिय कर सकते हैं में परिणाम. EL222 पर आधारित कई सर्किट विकसित किए गए हैं और S. cerevisiae में रासायनिक उत्पादन के लिए उपयोग किए जाते हैं, जैसे कि मूल प्रकाश-सक्रिय OptoEXP system7, जिसमें ब्याज का जीन सीधे PC120 (चित्रा 1A) से व्यक्त किया जाता है। हालांकि, उच्च सेल घनत्व पर प्रकाश प्रवेश की चिंताओं को आमतौर पर किण्वन के उत्पादन चरण में सामना करना पड़ता है, हमें उल्टे सर्किट विकसित करने के लिए प्रेरित किया जाता है जो अंधेरे में प्रेरित होते हैं, जैसे कि OptoINVRT और OptoQ-INVRT सर्किट (चित्रा 1B) 5,7,13। ये प्रणालियां गैलेक्टोज (जीएएल) या क्विनिक एसिड (क्यू) रेग्यूलन को क्रमशः एस सेरेविसिया और एन क्रैसा से उपयोग करती हैं, जो वीपी 16-ईएल 222 के साथ अपने संबंधित दमनकर्ताओं (GAL80 और QS) को नियंत्रित करती हैं, ताकि प्रकाश में जीन अभिव्यक्ति को दबाया जा सके और इसे अंधेरे में दृढ़ता से प्रेरित किया जा सके। OptoEXP और OptoINVRT सर्किट के संयोजन के परिणामस्वरूप जीन अभिव्यक्ति का द्विदिश नियंत्रण होता है, जिससे दो-चरण किण्वन सक्षम होते हैं जिसमें विकास चरण नीली रोशनी के साथ प्रेरित होता है, और अंधेरे के साथ उत्पादन चरण (चित्रा 2 ए) 5,7।
उत्पादन चरण के दौरान जीन अभिव्यक्ति को प्रेरित करने के लिए अंधेरे के बजाय प्रकाश का उपयोग करने से ऑप्टोजेनेटिक नियंत्रण की क्षमताओं का बहुत विस्तार होगा, लेकिन आमतौर पर किण्वन के इस चरण में सामना किए जाने वाले उच्च सेल घनत्व की प्रकाश प्रवेश सीमाओं पर काबू पाने की भी आवश्यकता होगी। इस अंत तक, हमने सर्किट विकसित किए हैं, जिन्हें OptoAMP और OptoQ-AMP के रूप में जाना जाता है, जो नीली रोशनी उत्तेजना के लिए ट्रांसक्रिप्शनल प्रतिक्रिया को बढ़ाते हैं। ये सर्किट VP16-EL222 के जंगली-प्रकार या अतिसंवेदनशील उत्परिवर्ती का उपयोग करते हैं ताकि GAL या Q regulons के ट्रांसक्रिप्शनल एक्टिवेटर Gal4p या QF2 के उत्पादन को नियंत्रित किया जा सके, क्रमशः, light12,13 (चित्रा 1C) के साथ बढ़ी हुई संवेदनशीलता और मजबूत जीन अभिव्यक्ति प्राप्त की जा सके। OptoAMP सर्किट एक ऑप्टिकल घनत्व (600 एनएम पर मापा) पर 5 एल बायोरिएक्टर में पूर्ण और सजातीय प्रकाश प्रेरण प्राप्त कर सकते हैं; OD600) कम से कम 40 के मूल्यों में केवल ~ 0.35% रोशनी के साथ (थोक सतह के केवल ~ 7% पर 5% प्रकाश खुराक)। यह OptoEXP की तुलना में संवेदनशीलता की एक उच्च डिग्री को दर्शाता है, जिसके लिए 100% रोशनी 12 के करीब की आवश्यकता होती है। उच्च कोशिका घनत्व पर प्रकाश के साथ जीन अभिव्यक्ति को प्रभावी ढंग से प्रेरित करने की क्षमता किण्वन के गतिशील नियंत्रण के लिए नए अवसर खोलती है। इसमें दो से अधिक अस्थायी चरणों में ऑपरेटिंग किण्वन शामिल हैं, जैसे कि तीन-चरण किण्वन, जिसमें विकास, प्रेरण और उत्पादन चरण रासायनिक उत्पादन को अनुकूलित करने के लिए अद्वितीय प्रकाश अनुसूचियों के साथ स्थापित किए जाते हैं (चित्रा 2 बी) 12।
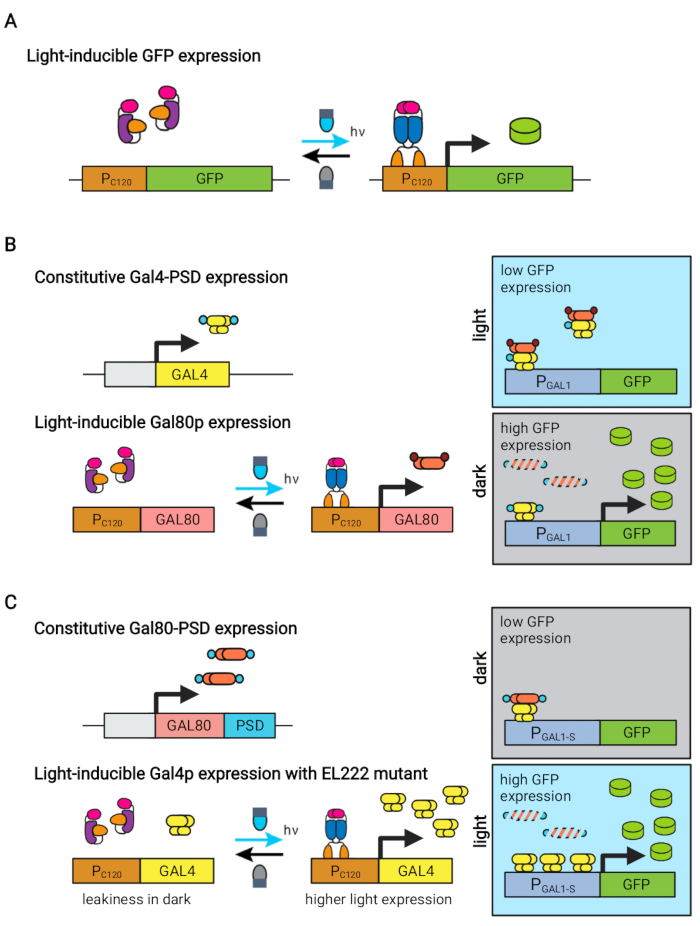
चित्रा 1: S. cerevisiae के गतिशील नियंत्रण के लिए ऑप्टोजेनेटिक सर्किट। OptoEXP, OptoINVRT, और OptoAMP सर्किट प्रकाश-संवेदनशील VP16-EL222 सिस्टम पर आधारित हैं। (ए) ऑप्टोएक्सपी सर्किट में, नीली रोशनी के संपर्क में आने से वीपी 16-ईएल 222 के एक संरचनात्मक परिवर्तन और dimerization का कारण बनता है, जो डीएनए-बाइंडिंग डोमेन को उजागर करता है और PC120 से प्रतिलेखन की अनुमति देता है। इस आंकड़े को झाओ एट अल.7 से संशोधित किया गया है। (बी) OptoINVRT सर्किट अंधेरे में अभिव्यक्ति को प्रेरित करने के लिए GAL (दिखाया गया) या Q regulons का दोहन करता है। GAL-आधारित परिपथों में, VP16-EL222 और GAL4 को संरचनात्मक रूप से व्यक्त किया जाता है, जबकि PC120 GAL80 दमनकारी की अभिव्यक्ति को चलाता है (Q-आधारित सर्किट में, GAL4 और GAL80 को क्रमशः QF2 और QS द्वारा प्रतिस्थापित किया जाता है, और GAL प्रमोटर के बजाय एक सिंथेटिक QUAS-युक्त प्रमोटर का उपयोग किया जाता है)। प्रकाश में, Gal80p PGAL1 से ब्याज के जीन के सक्रियण को रोकता है। अंधेरे में, GAL80 व्यक्त नहीं किया जाता है और इसे एक संवैधानिक डिग्रोन डोमेन (छोटे भूरे रंग के डोमेन) में फ्यूज करके तेजी से अपमानित किया जाता है, जो Gal4p द्वारा PGAL1 के सक्रियण के लिए अनुमति देता है। यह आंकड़ा झाओ एट अल.5 से संशोधित किया गया है। (C) OptoAMP सर्किट भी VP16-EL222 का उपयोग करने के लिए GAL (दिखाया गया) या Q regulons को नियंत्रित करने के लिए। इन सर्किटों में, GAL80 दमनकारी (या क्यूएस) को संरचनात्मक रूप से व्यक्त किया जाता है और अंधेरे में तंग दमन सुनिश्चित करने वाले फोटो-संवेदनशील डिग्रोन (छोटे नीले डोमेन) से जुड़ा होता है। PC120 और एक अतिसंवेदनशील VP16-EL222 उत्परिवर्ती नियंत्रण अभिव्यक्ति GAL4 (या QF2) प्रकाश के साथ, जो दृढ़ता से प्रकाश में PGAL1 (या एक QUAS युक्त प्रमोटर) को सक्रिय करता है। GAL-व्युत्पन्न सर्किट PGAL1 के इंजीनियर रूपों का उपयोग कर सकते हैं, जैसे कि PGAL1-M या PGAL1-S, जिसमें गतिविधि में वृद्धि हुई है, साथ ही GAL regulon (PGAL1, PGAL10, PGAL2, PGAL7) द्वारा नियंत्रित जंगली प्रकार के प्रमोटर भी हैं। इस आकृति को Zhao et al.12 से संशोधित किया गया है। कृपया इस आकृति का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
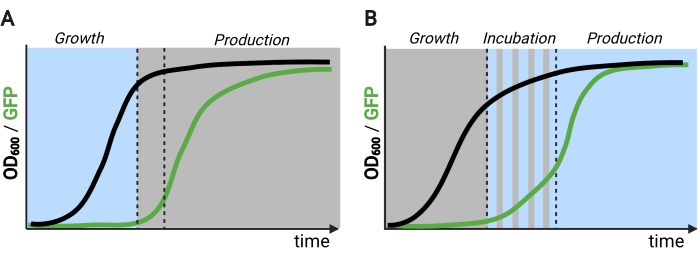
चित्र 2: समय के माध्यम से दो- और तीन-चरण किण्वन। (A) उल्टे सर्किट के साथ संचालित दो-चरण किण्वनों में एक प्रकाश-संचालित विकास चरण और एक अंधेरे उत्पादन चरण शामिल होते हैं। विकास चरण में, बायोमास जमा होता है क्योंकि उत्पादन मार्ग दमित रहता है। वांछित OD600 तक पहुंचने पर, कोशिकाओं को उत्पादन चरण के लिए ताजा मीडिया में पुन: निलंबित होने से पहले चयापचय रूप से समायोजित करने के लिए अंधेरे में स्थानांतरित कर दिया जाता है। (बी) तीन चरण की प्रक्रिया में, विकास, इनक्यूबेशन, और उत्पादन चरणों को अद्वितीय प्रकाश अनुसूचियों द्वारा परिभाषित किया जाता है, जिसमें एक अंधेरे विकास अवधि, स्पंदित इनक्यूबेशन और पूरी तरह से प्रकाशित उत्पादन चरण शामिल हो सकते हैं। चित्र Biorender के साथ बनाया गया. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
ऑप्टोजेनेटिक सर्किट भी ई कोलाई में रासायनिक और प्रोटीन उत्पादन के गतिशील नियंत्रण के लिए विकसित किए गए हैं। OptoLAC सर्किट प्रकाश-उत्तरदायी pDawn सर्किट का उपयोग करके जीवाणु LacI दमनकारी को नियंत्रित करते हैं, जो YF1 / FixJ दो-घटक system6 (चित्रा 3) पर आधारित है। OptoINVRT5 के समान, OptoLAC सर्किट को प्रकाश में जीन अभिव्यक्ति को दबाने और अंधेरे में इसे प्रेरित करने के लिए डिज़ाइन किया गया है। OptoLAC सर्किट का उपयोग करके अभिव्यक्ति का स्तर मानक आइसोप्रोपाइल β-डी-1-थायोगैलेक्टोप्रानोसाइड (आईपीटीजी) प्रेरण के साथ प्राप्त किए गए लोगों से मेल खा सकता है या उससे अधिक हो सकता है, इस प्रकार रासायनिक प्रेरण की ताकत को बनाए रखता है, जबकि बढ़ी हुई ट्यूनेबिलिटी और उत्क्रमण 6 की पेशकश करता है। इसलिए, ऑप्टोलैक सर्किट ई कोलाई में चयापचय इंजीनियरिंग के लिए प्रभावी ऑप्टोजेनेटिक नियंत्रण को सक्षम करते हैं।
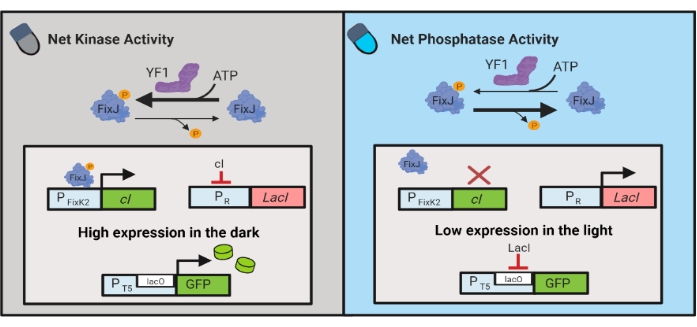
चित्रा 3: ई कोलाई के गतिशील नियंत्रण के लिए OptoLAC सर्किट। OptoLAC सर्किट अंधेरे में सक्रियण और प्रकाश में दमन प्राप्त करने के लिए pDawn प्रणाली और लाख operon अनुकूलित. अंधेरे में, YF1 फॉस्फोराइलेट्स FixJ, जो तब CI दमनकर्ता को व्यक्त करने के लिए PFixK2 प्रमोटर को सक्रिय करता है। सीआई दमनकारी पीआर प्रमोटर से एलएसीआई दमनकर्ता की अभिव्यक्ति को रोकता है, जो एक लाखो-युक्त प्रमोटर से ब्याज के जीन के प्रतिलेखन की अनुमति देता है। इसके विपरीत, नीली रोशनी वाईएफ 1 नेट किनेज गतिविधि को कम करती है, फिक्सजे फॉस्फोराइलेशन को उलट देती है और इस प्रकार सीआई अभिव्यक्ति, जो एलएसीआई की अभिव्यक्ति को कम करती है और एलएसीओ-युक्त प्रमोटर से अभिव्यक्ति को रोकती है। इस आंकड़े को लालवानी एट अल.6 से संशोधित किया गया है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
हम यहां रासायनिक या प्रोटीन उत्पादन के लिए एस सेरेविसिया और ई कोलाई के प्रकाश-नियंत्रित किण्वन के लिए बुनियादी प्रोटोकॉल का वर्णन करते हैं। खमीर और बैक्टीरिया दोनों के लिए, हम पहले एक प्रकाश-संचालित विकास चरण और ऑप्टोइनवीआरटी और ऑप्टोलैक सर्किट द्वारा सक्षम एक अंधेरे-प्रेरित उत्पादन चरण के साथ किण्वन पर ध्यान केंद्रित करते हैं। इसके बाद, हम ऑप्टोएएमपी सर्किट द्वारा सक्षम तीन-चरण (विकास, प्रेरण, उत्पादन) प्रकाश-नियंत्रित किण्वन के लिए एक प्रोटोकॉल का वर्णन करते हैं। इसके अलावा, हम वर्णन करते हैं कि माइक्रोप्लेट से लैब-स्केल बायोरिएक्टर तक ऑप्टोजेनेटिक रूप से नियंत्रित किण्वन को कैसे बढ़ाया जाए। इस प्रोटोकॉल के साथ, हम रासायनिक या प्रोटीन उत्पादन के लिए प्रकाश-नियंत्रित किण्वन करने के लिए एक पूर्ण और आसानी से पुन: प्रस्तुत करने योग्य मार्गदर्शिका प्रदान करना चाहते हैं।
Protocol
Representative Results
Discussion
गतिशील नियंत्रण लंबे समय से चयापचय इंजीनियरिंग और पुनः संयोजक प्रोटीन उत्पादन के लिए पैदावार में सुधार करने के लिए लागू किया गया है4. एंजाइमेटिक अभिव्यक्ति में बदलाव को आमतौर पर आईपीटीजी <sup clas…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
इस शोध को अमेरिकी ऊर्जा विभाग, विज्ञान के कार्यालय, जैविक और पर्यावरण अनुसंधान पुरस्कार संख्या DE-SC0019363 के कार्यालय, NSF कैरियर पुरस्कार CBET-1751840, प्यू चैरिटेबल ट्रस्ट, और कैमिल ड्रेफस शिक्षक-विद्वान पुरस्कार द्वारा समर्थित किया गया था।
Materials
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Riferimenti
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioingegneria. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).

