Fermentazioni a controllo leggero per la produzione chimica microbica e proteica
Summary
Il controllo optogenetico del metabolismo microbico offre un controllo dinamico flessibile sui processi di fermentazione. Il protocollo qui mostra come impostare fermentazioni regolate dalla luce blu per la produzione chimica e proteica a diverse scale volumetriche.
Abstract
Le fabbriche di cellule microbiche offrono un’alternativa sostenibile per la produzione di sostanze chimiche e proteine ricombinanti da materie prime rinnovabili. Tuttavia, sovraccaricare un microrganismo con modificazioni genetiche può ridurre la forma fisica e la produttività dell’ospite. Questo problema può essere superato utilizzando il controllo dinamico: espressione inducibile di enzimi e percorsi, in genere utilizzando additivi chimici o nutrizionali, per bilanciare la crescita e la produzione cellulare. L’optogenetica offre un metodo non invasivo, altamente sintonizzabile e reversibile per regolare dinamicamente l’espressione genica. Qui, descriviamo come impostare fermentazioni controllate dalla luce di Escherichia coli ingegnerizzato e Saccharomyces cerevisiae per la produzione di sostanze chimiche o proteine ricombinanti. Discutiamo di come applicare la luce in momenti e dosaggi selezionati per disaccoppiare la crescita e la produzione microbica per migliorare il controllo e la produttività della fermentazione, nonché le considerazioni chiave di ottimizzazione per i migliori risultati. Inoltre, descriviamo come implementare i controlli della luce per esperimenti di bioreattori su scala di laboratorio. Questi protocolli facilitano l’adozione di controlli optogenetici in microrganismi ingegnerizzati per migliorare le prestazioni di fermentazione.
Introduction
L’optogenetica, il controllo dei processi biologici con proteine sensibili alla luce, offre una nuova strategia per controllare dinamicamente le fermentazioni microbiche per la produzione chimica e proteica1,2. L’onere delle vie metaboliche ingegnerizzate e la tossicità di alcuni intermedi e prodotti spesso compromettono la crescita cellulare3. Tali sollecitazioni possono portare a uno scarso accumulo di biomassa e a una ridotta produttività3. Questa sfida può essere affrontata dividendo temporalmente le fermentazioni in una fase di crescita e produzione, che dedicano risorse metaboliche rispettivamente all’accumulo di biomassa o alla sintesi del prodotto4. Recentemente abbiamo dimostrato che il passaggio dalla crescita alla produzione in questa fermentazione bifase può essere indotto con cambiamenti nelle condizioni di illuminazione5,6,7. L’elevata sintonizzazione, reversibilità e ortogonalità degli ingressi luminosi8 offre vantaggi unici alle fermentazioni controllate dalla luce che sono difficili o impossibili da replicare con induttori chimici utilizzati nel controllo dinamico delle fermentazioni bifase convenzionali4,9,10,11.
La proteina EL222 sensibile alla luce blu derivata da Erythrobacter litoralis è stata utilizzata per sviluppare diversi circuiti optogenetici per l’ingegneria metabolica in Saccharomyces cerevisiae5,7,12,13. EL222 contiene un dominio LOV (Light-Oxygen-Voltage Sensor) che subisce uno spostamento conformazionale all’attivazione della luce blu (465 nm), che gli consente di legarsi alla sua sequenza di DNA affine (C120)13. La fusione di EL222 con il dominio di attivazione virale VP16 (VP16-EL222) si traduce in un fattore di trascrizione sensibile alla luce blu che può attivare in modo reversibile l’espressione genica in S. cerevisiae7 e altri organismi14 dal promotore sintetico PC120. Diversi circuiti basati su EL222 sono stati sviluppati e utilizzati per la produzione chimica in S. cerevisiae, come il sistema optoEXP di base attivato dalla luce7, in cui il gene di interesse è espresso direttamente da PC120 (Figura 1A). Tuttavia, le preoccupazioni di penetrazione della luce alle alte densità cellulari tipicamente incontrate nella fase di produzione delle fermentazioni ci hanno motivato a sviluppare circuiti invertiti indotti al buio, come i circuiti OptoINVRT e OptoQ-INVRT (Figura 1B)5,7,13. Questi sistemi sfruttano i regolaloni di galattosio (GAL) o acido chinico (Q) di S. cerevisiae e N. crassa, rispettivamente, controllando i loro corrispondenti repressori (GAL80 e QS) con VP16-EL222, per reprimere l’espressione genica alla luce e indurla fortemente al buio. La combinazione dei circuiti OptoEXP e OptoINVRT si traduce in un controllo bidirezionale dell’espressione genica, consentendo fermentazioni bifase in cui la fase di crescita è indotta con luce blu e la fase di produzione con oscurità (Figura 2A)5,7.
L’uso della luce al posto dell’oscurità per indurre l’espressione genica durante la fase di produzione espanderebbe notevolmente le capacità dei controlli optogenetici, ma richiederebbe anche il superamento dei limiti di penetrazione della luce delle alte densità cellulari tipicamente incontrate in questa fase di fermentazione. A tal fine, abbiamo sviluppato circuiti, noti come OptoAMP e OptoQ-AMP, che amplificano la risposta trascrizionale alla stimolazione della luce blu. Questi circuiti utilizzano mutanti wild-type o ipersensibili di VP16-EL222 per controllare la produzione degli attivatori trascrizionali Gal4p o QF2 dei reguloni GAL o Q, rispettivamente, ottenendo una maggiore sensibilità e una maggiore espressione genica con la luce12,13 (Figura 1C). I circuiti OptoAMP possono ottenere un’induzione luminosa completa e omogenea in bioreattori da 5 L a densità ottica (misurata a 600 nm; OD600) valori di almeno 40 con solo ~0,35% di illuminazione (5% di dose di luce solo su ~7% della superficie di massa). Ciò dimostra un grado di sensibilità più elevato rispetto a OptoEXP, che richiede un’illuminazione vicina al 100%12. La capacità di indurre efficacemente l’espressione genica con la luce ad alte densità cellulari apre nuove opportunità per il controllo dinamico delle fermentazioni. Ciò include fermentazioni operative in più di due fasi temporali, come le fermentazioni trifase, in cui le fasi di crescita, induzione e produzione sono stabilite con programmi leggeri unici per ottimizzare la produzione chimica (Figura 2B)12.
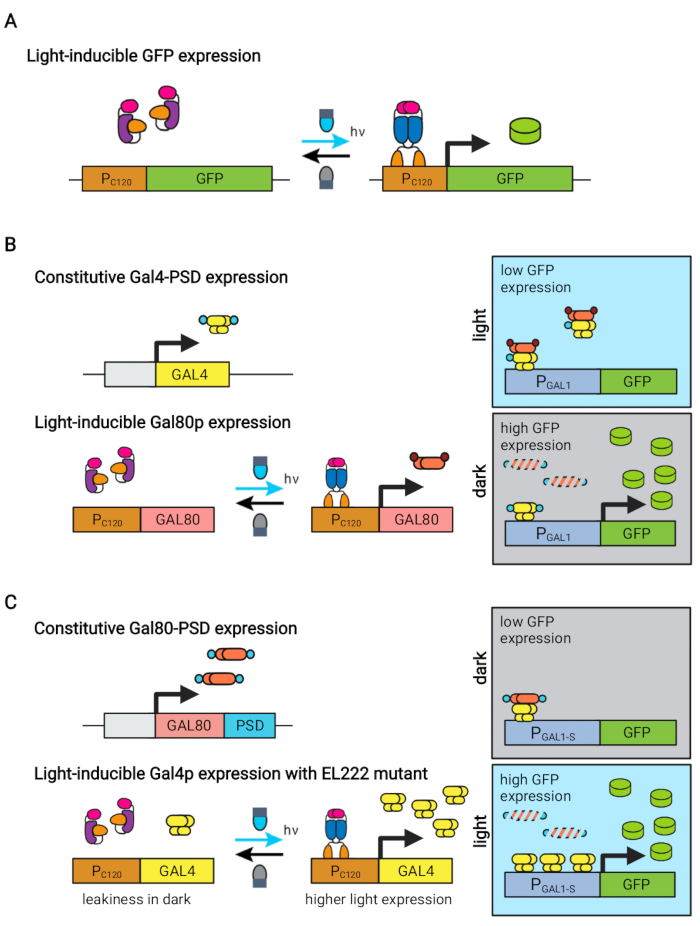
Figura 1: Circuiti optogenetici per il controllo dinamico di S. cerevisiae. I circuiti OptoEXP, OptoINVRT e OptoAMP si basano sul sistema VP16-EL222 sensibile alla luce. (A) Nel circuito OptoEXP, l’esposizione alla luce blu provoca un cambiamento conformazionale e la dimerizzazione di VP16-EL222, che espone un dominio legante il DNA e consente la trascrizione da PC120. La figura è stata modificata da Zhao et al.7. (B) I circuiti OptoINVRT sfruttano i regolagni GAL (mostrati) o Q per indurre l’espressione al buio. Nei circuiti basati su GAL, VP16-EL222 e GAL4 sono espressi costitutivamente, mentre PC120 guida l’espressione del repressore GAL80 (nei circuiti basati su Q, GAL4 e GAL80 sono sostituiti rispettivamente da QF2 e QS e viene utilizzato un promotore sintetico contenente QUAS al posto di un promotore GAL). Alla luce, Gal80p impedisce l’attivazione del gene di interesse da PGAL1. Al buio, GAL80 non è espresso e rapidamente degradato fondendolo in un dominio costitutivo di degron (piccolo dominio marrone), che consente l’attivazione di PGAL1 da parte di Gal4p. La figura è stata modificata da Zhao et al.5. (C) I circuiti OptoAMP utilizzano anche VP16-EL222 per controllare i reguloni GAL (mostrato) o Q. In questi circuiti, il repressore GAL80 (o QS) è costitutivamente espresso e fuso in un degron fotosensibile (piccolo dominio blu) che garantisce una stretta repressione al buio. PC120 e un’espressione di controllo mutante ipersensibile VP16-EL222 di GAL4 (o QF2) con la luce, che attiva fortemente PGAL1 (o un promotore contenente QUAS) nella luce. I circuiti derivati da GAL possono utilizzare forme ingegnerizzate di PGAL1, come PGAL1-M o PGAL1-S, che hanno aumentato l’attività, così come promotori wild-type controllati dal regulon GAL (PGAL1, PGAL10, PGAL2, PGAL7). La figura è stata modificata da Zhao et al.12. Fare clic qui per visualizzare una versione più grande di questa figura.
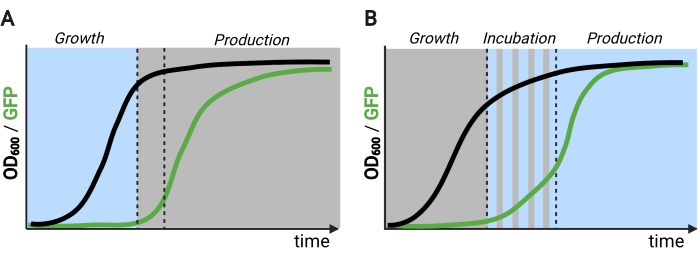
Figura 2: Fermentazioni a due e tre fasi nel tempo. (A) Le fermentazioni bifase operate con circuiti invertiti consistono in una fase di crescita guidata dalla luce e una fase di produzione scura. Nella fase di crescita, la biomassa si accumula mentre il percorso di produzione rimane represso. Al raggiungimento dell’OD600 desiderato, le cellule vengono spostate al buio per regolarsi metabolicamente prima di essere risospese in mezzi freschi per la fase di produzione. (B) In un processo in tre fasi, le fasi di crescita, incubazione e produzione sono definite da programmi di luce unici, che possono consistere in un periodo di crescita scuro, incubazione pulsata e fase di produzione completamente illuminata. Figura creata con Biorender. Fare clic qui per visualizzare una versione più grande di questa figura.
Sono stati inoltre sviluppati circuiti optogenetici per il controllo dinamico della produzione chimica e proteica in E. coli. I circuiti OptoLAC controllano il repressore batterico LacI utilizzando il circuito pDawn sensibile alla luce, basato sul sistema bicomponente YF1/FixJ6 (Figura 3). Simile a OptoINVRT5, i circuiti OptoLAC sono progettati per reprimere l’espressione genica nella luce e indurla al buio. I livelli di espressione che utilizzano circuiti OptoLAC possono eguagliare o superare quelli raggiunti con l’induzione standard isopropil β-d-1-tiogalattopoliranoside (IPTG), mantenendo così la forza dell’induzione chimica offrendo al contempo una maggiore sintonizzazione e reversibilità6. Pertanto, i circuiti OptoLAC consentono un efficace controllo optogenetico per l’ingegneria metabolica in E. coli.
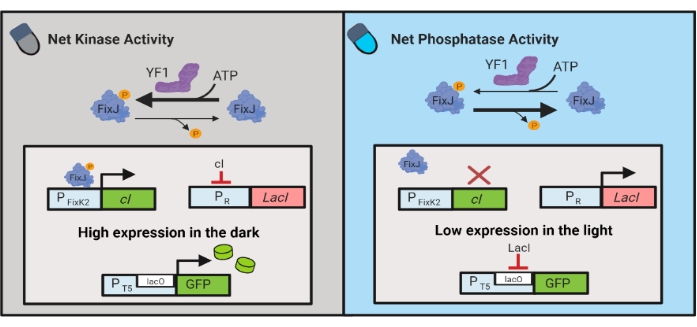
Figura 3: Circuiti OptoLAC per il controllo dinamico di E. coli. I circuiti OptoLAC adattano il sistema pDawn e l’operone lac per ottenere l’attivazione al buio e la repressione alla luce. Al buio, YF1 fosforila FixJ, che quindi attiva il promotore PFixK2 per esprimere il repressore cI . Il repressore cI impedisce l’espressione del repressore lacI dal promotore PR , che consente la trascrizione del gene di interesse da un promotore contenente lacO. Al contrario, la luce blu riduce l’attività della chinasi netta YF1, invertendo la fosforilazione di FixJ e quindi l’espressione di cI , che dereprime l’espressione di lacI e impedisce l’espressione dal promotore contenente lacO. La figura è stata modificata da Lalwani et al.6. Fare clic qui per visualizzare una versione più grande di questa figura.
Descriviamo qui i protocolli di base per le fermentazioni controllate dalla luce di S. cerevisiae ed E. coli per la produzione chimica o proteica. Sia per i lieviti che per i batteri, ci concentriamo innanzitutto sulle fermentazioni con una fase di crescita guidata dalla luce e una fase di produzione indotta dall’oscurità abilitata dai circuiti OptoINVRT e OptoLAC. Successivamente, descriviamo un protocollo per una fermentazione a tre fasi (crescita, induzione, produzione) controllata dalla luce abilitata dai circuiti OptoAMP. Inoltre, descriviamo come aumentare le fermentazioni optogeneticamente controllate dalle micropiastre ai bioreattori su scala di laboratorio. Con questo protocollo, miriamo a fornire una guida completa e facilmente riproducibile per eseguire fermentazioni controllate dalla luce per la produzione chimica o proteica.
Protocol
Representative Results
Discussion
Il controllo dinamico è stato a lungo applicato per migliorare le rese per l’ingegneria metabolica e la produzione di proteine ricombinanti4. I cambiamenti nell’espressione enzimatica sono più tipicamente implementati utilizzando induttori chimici come IPTG21, galattosio22 e tetraciclina23, ma sono stati anche mediati utilizzando condizioni di processo come temperatura e pH. Il controllo optogenetico dell’espressione genica …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata sostenuta dal Dipartimento dell’Energia degli Stati Uniti, dall’Office of Science, dall’Office of Biological and Environmental Research Award Number DE-SC0019363, dal NSF CAREER Award CBET-1751840, dal Pew Charitable Trusts e dal Camille Dreyfus Teacher-Scholar Award.
Materials
| Light-controlled chemical production using S. cerevisiae | |||
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Agar powder | Thermo Fisher Scientific | 303991049 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| EZ-L439 OptoINVRT7 Plasmid | N/A | N/A | See Reference 1 |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| PmeI | New England Biolabs | R0560L | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| Replica-plating device | Thomas Scientific | F37848-0000 | |
| Replica-plating pads | Sunrise Science Products | 3005-012 | |
| SC-His powder | Sunrise Science Products | 1303-030 | |
| SC Complete powder | Sunrise Science Products | 1459-100 | |
| Sterile sealing film | Excel Scientific | STR-SEAL-PLT | |
| YPD agar plates | VWR | 100217-054 | |
| Zeocin | Thermo Fisher Scientific | R25005 | |
| Light-controlled protein production using E. coli | |||
| 6X SDS Sample Buffer | Cepham Life Sciences | 10502 | |
| 12% Acrylamide protein gels | Thermo Fisher Scientific | NP0341BOX | |
| 24-well culture plate | USA Scientific | CC7672-7524 | |
| Aluminum foil | Reynolds | B004NG90YO | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Blue LED panel | HQRP | 884667106091218 | |
| Coomassie Brilliant Blue G-250 | Thermo Fisher Scientific | 20279 | |
| Electrophoresis cell | Bio-Rad | 1658004 | |
| Electrophoresis power supply | Bio-Rad | 1645050 | |
| LB broth (Miller) | Fisher Scientific | BP97235 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NaCl | Thomas Scientific | SX0425-1 | |
| OptoLAC plasmids | N/A | N/A | See Reference 2 |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Petri dish | Celltreat | 229656 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SOC medium | Thermo Fisher Scientific | 15544034 | |
| Thermomixer | Eppendorf | 5382000015 | |
| Tris base | Fisher Scientific | BP1521 | |
| Three-phase fermentation using S. cerevisiae | |||
| Same materials as "Light-controlled chemical production using S. cerevisiae" protocol plus the following: | |||
| EZ-L580 OptoAMP4 Plasmid | N/A | N/A | See Reference 10 |
| Chemical production in a light-controlled bioreactor | |||
| Aluminum foil | Reynolds | B004NG90YO | |
| Antifoam | Sigma-Aldrich | A8311 | |
| Bioreactor with control station | Eppendorf | B120110001 | |
| BioSpectrometer with μcuvette | Eppendorf | 6135000923 | |
| Bleach | VWR Scientific | 89501-620 (CS) | |
| Blue LED panel | HQRP | 884667106091218 | |
| BPT tubing | Fisher Scientific | 14-170-15 | |
| Glucose | Thermo Fisher Scientific | 501879892 (G8270-5KG) | |
| Hydrochloric acid (HCl) | Fisher Scientific | 7647-01-0 | |
| M9 Minimal Salts | Thermo Fisher Scientific | A1374401 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002403 | |
| Microcentrifuge tubes | USA Scientific | 1615-5510 | |
| NH4OH Solution | Sigma-Aldrich | I0503-1VL | |
| Orbital Shaker | Yamato Scientific America | SOU-300 | |
| Quantum meter | Apogee Instruments | MQ-510 | |
| SC Complete powder | Sunrise Science Products | 1459-100 |
Riferimenti
- Figueroa, D., Rojas, V., Romero, A., Larrondo, L. F., Salinas, F. The rise and shine of yeast optogenetics. Yeast. 38 (2), 131-146 (2021).
- Pouzet, S., et al. The promise of optogenetics for bioproduction: Dynamic control strategies and scale-up instruments. Bioingegneria. 7 (4), 151 (2020).
- Venayak, N., Anesiadis, N., Cluett, W. R., Mahadevan, R. Engineering metabolism through dynamic control. Current Opinion in Biotechnology. 34, 142-152 (2015).
- Lalwani, M. A., Zhao, E. M., Avalos, J. L. Current and future modalities of dynamic control in metabolic engineering. Current Opinion in Biotechnology. 52, 56-65 (2018).
- Zhao, E. M., et al. Design and characterization of rapid optogenetic circuits for dynamic control in yeast metabolic engineering. ACS Synthetic Biology. 9 (12), 3254-3266 (2020).
- Lalwani, M. A., et al. Optogenetic control of the lac operon for bacterial chemical and protein production. Nature Chemical Biology. 17 (1), 71-79 (2021).
- Zhao, E. M., et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature. 555 (7698), 683-687 (2018).
- Baumschlager, A., Khammash, M. Synthetic biological approaches for optogenetics and tools for transcriptional light-control in bacteria. Advanced Biology. 5 (5), 2000256 (2021).
- Dvorak, P., et al. Exacerbation of substrate toxicity by IPTG in Escherichia coli BL21(DE3) carrying a synthetic metabolic pathway. Microbial Cell Factories. 14, 201 (2015).
- Hartline, C. J., Schmitz, A. C., Han, Y., Zhang, F. Dynamic control in metabolic engineering: Theories, tools, and applications. Metabolic Engineering. 63, 126-140 (2021).
- Ni, C., Dinh, C. V., Prather, K. L. J. Dynamic control of metabolism. Annual Review of Chemical and Biomolecular Engineering. 12, 519-560 (2021).
- Zhao, E. M., et al. Optogenetic amplification circuits for light-induced metabolic control. ACS Synthetic Biology. 10 (5), 1143-1154 (2021).
- Lalwani, M. A., Zhao, E. M., Wegner, S. A., Avalos, J. L. The Neurospora crassa Inducible Q System Enables Simultaneous Optogenetic Amplification and Inversion in Saccharomyces cerevisiae for Bidirectional Control of Gene Expression. ACS Synthetic Biology. 10 (8), 2060-2075 (2021).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Marx, H., Mecklenbräuker, A., Gasser, B., Sauer, M., Mattanovich, D. Directed gene copy number amplification in Pichia pastoris by vector integration into the ribosomal DNA locus. FEMS Yeast Research. 9 (8), 1260-1270 (2009).
- Nordén, K., et al. Increasing gene dosage greatly enhances recombinant expression of aquaporins in Pichia pastoris. BMC Biotechnology. 11, 47 (2011).
- Zhao, E. M., et al. Light-based control of metabolic flux through assembly of synthetic organelles. Nature Chemical Biology. 15 (6), 589-597 (2019).
- Dowee, W. J., Miller, J. F., Ragsdale, C. W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Research. 16 (13), 6127-6145 (1988).
- Zhou, K., Edgar, S., Stephanopoulos, G. Engineering microbes to synthesize plant isoprenoids. Methods in Enzymology. 575, 225-245 (2016).
- Arfman, N., Worrell, V., Ingram, L. O. Use of the tac promoter and lacI(q) for the controlled expression of Zymomonas mobilis fermentative genes in Escherichia coli and Zymomonas mobilis. Journal of Bacteriology. 174 (22), 7370-7378 (1992).
- Steen, E. J., et al. Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol. Microbial Cell Factories. 7 (1), 1-8 (2008).
- Tan, S. Z., Manchester, S., Prather, K. L. J. Controlling central carbon metabolism for improved pathway yields in Saccharomyces cerevisiae. ACS Synthetic Biology. 5 (2), 116-124 (2015).
- Jayaraman, P., et al. Blue light-mediated transcriptional activation and repression of gene expression in bacteria. Nucleic Acids Research. 44 (14), 6994 (2016).
- Fernandez-Rodriguez, J., Moser, F., Song, M., Voigt, C. A. Engineering RGB color vision into Escherichia coli. Nature Chemical Biology. 13 (7), 706-708 (2017).
- Ding, Q., et al. Light-powered Escherichia coli cell division for chemical production. Nature Communications. 11 (1), 1-14 (2020).
- Senoo, S., Tandar, S. T., Kitamura, S., Toya, Y., Shimizu, H. Light-inducible flux control of triosephosphate isomerase on glycolysis in Escherichia coli. Biotechnology and Bioengineering. 116 (12), 3292-3300 (2019).
- Ramakrishnan, P., Tabor, J. J. Repurposing synechocystis PCC6803 UirS-UirR as a UV-violet/green photoreversible transcriptional regulatory tool in E. Coli. ACS Synthetic Biology. 5 (7), 733-740 (2016).
- Tabor, J. J., Levskaya, A., Voigt, C. A. Multichromatic control of gene expression in escherichia coli. Journal of Molecular Biology. 405 (2), 315-324 (2011).
- Stewart, C. J., McClean, M. N. Design and implementation of an automated illuminating, culturing, and sampling system for microbial optogenetic applications. Journal of Visualized Experiments:JoVE. (120), e54894 (2017).
- Grødem, E. O. S., Sweeney, K., McClean, M. N. Automated calibration of optoPlate LEDs to reduce light dose variation in optogenetic experiments. BioTechniques. 69 (4), 313-316 (2020).
- Gerhardt, K. P., et al. An open-hardware platform for optogenetics and photobiology. Scientific Reports. 6, (2016).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Steel, H., Habgood, R., Kelly, C., Papachristodoulou, A. In situ characterisation and manipulation of biological systems with Chi.Bio. PLoS Biology. 18 (7), (2020).
- Carrasco-López, C., García-Echauri, S. A., Kichuk, T., Avalos, J. L. Optogenetics and biosensors set the stage for metabolic cybergenetics. Current Opinion in Biotechnology. 65, 296-309 (2020).
- Milias-Argeitis, A., Rullan, M., Aoki, S. K., Buchmann, P., Khammash, M. Automated optogenetic feedback control for precise and robust regulation of gene expression and cell growth. Nature Communications. 7 (1), 1-11 (2016).
- Melendez, J., et al. Real-time optogenetic control of intracellular protein concentration in microbial cell cultures. Integrative Biology: Quantitative Biosciences From Nano to Macro. 6 (3), 366-372 (2014).
- Milias-Argeitis, A., et al. In silico feedback for in vivo regulation of a gene expression circuit. Nature Biotechnology. 29 (12), 1114-1116 (2011).
- Castillo-Hair, S. M., Baerman, E. A., Fujita, M., Igoshin, O. A., Tabor, J. J. Optogenetic control of Bacillus subtilis gene expression. Nature Communications. 10 (1), 1-11 (2019).
- Xia, A., et al. Optogenetic modification of pseudomonas aeruginosa enables controllable twitching motility and host infection. ACS Synthetic Biology. 10 (3), 531-541 (2021).
- Pu, L., Yang, S., Xia, A., Jin, F. Optogenetics manipulation enables prevention of biofilm formation of engineered pseudomonas aeruginosa on surfaces. ACS Synthetic Biology. 7 (1), 200-208 (2018).

