تحديد تقارب الارتباط (KD) للأجسام المضادة ذات العلامات المشعة للمستضدات المجمدة
Summary
هنا ، يتم وصف طريقة لتحديد تقارب الارتباط (KD) للأجسام المضادة ذات العلامات المشعة للمستضدات المجمدة. KD هو ثابت تفكك التوازن الذي يمكن تحديده من تجربة ربط التشبع عن طريق قياس الارتباط الكلي والمحدد وغير المحدد لجسم مضاد يحمل علامة إشعاعية بتركيزات مختلفة لمستضدها.
Abstract
يعد تحديد تقارب الارتباط (KD) جانبا مهما من جوانب توصيف الأجسام المضادة ذات العلامات الإشعاعية (rAb). عادة ، يتم تمثيل تقارب الارتباط بثابت تفكك التوازن ، KD ، ويمكن حسابه على أنه تركيز الأجسام المضادة التي يتم فيها شغل نصف مواقع ربط الأجسام المضادة عند التوازن. يمكن تعميم هذه الطريقة على أي جسم مضاد يحمل علامة إشعاعية أو سقالات أخرى من البروتين والببتيد. وعلى النقيض من الطرق القائمة على الخلايا، فإن اختيار المستضدات المجمدة مفيد بشكل خاص للتحقق من صحة تقاربات الارتباط بعد التخزين طويل الأجل للأجسام المضادة، والتمييز بين التقاربات الملزمة لأذرع منطقة ربط المستضدات الشظايا (Fab) في تركيبات الأجسام المضادة ثنائية النوعية، وتحديد ما إذا كان هناك تباين في التعبير عن المستضد بين خطوط الخلايا المختلفة. تتضمن هذه الطريقة شل حركة كمية ثابتة من المستضد إلى آبار محددة على صفيحة قابلة للكسر من 96 بئرا. ثم ، تم حظر الربط غير المحدد في جميع الآبار مع ألبومين مصل البقر (BSA). في وقت لاحق ، تمت إضافة rAb في تدرج تركيز لجميع الآبار. تم اختيار مجموعة من التركيزات للسماح ل rAb بالوصول إلى التشبع ، أي تركيز الأجسام المضادة التي ترتبط فيها جميع المستضدات باستمرار ب rAb. في الآبار المعينة بدون مستضد مشدود ، يمكن تحديد الربط غير المحدد ل rAb. من خلال طرح الربط غير المحدد من الربط الكلي في الآبار باستخدام مستضد مجمد ، يمكن تحديد ربط محدد ل rAb بالمستضد. تم حساب KD من rAb من منحنى ربط التشبع الناتج. على سبيل المثال ، تم تحديد تقارب الارتباط باستخدام amivantamab المسمى إشعاعيا ، وهو جسم مضاد ثنائي النوعية لمستقبلات عامل نمو البشرة (EGFR) وبروتينات الانتقال الوسيط الوسيط الظهاري (cMET).
Introduction
الأجسام المضادة ذات العلامات الإشعاعية (rAb) لها مجموعة متنوعة من الاستخدامات في الطب. في حين يتم استخدام الغالبية العظمى في علم الأورام كعوامل تصوير وعلاجية ، هناك تطبيقات تصوير للالتهابات المرتبطة بالروماتيزم وأمراض القلب والأعصاب1. التصوير rAbs لديه حساسية عالية للكشف عن الآفات ولديه القدرة على المساعدة في اختيار المريض للعلاج2،3،4،5. كما أنها تستخدم للعلاج بسبب خصوصيتها لمستضداتها الخاصة. في استراتيجية تعرف باسم theranostics ، يتم استخدام نفس rAb لكل من التصوير والعلاج6.
من الناحية المثالية ، فإن الجسم المضاد المختار لوضع العلامات الإشعاعية هو واحد ثبت بالفعل أن لديه تقارب وخصوصية ربط عالية باستخدام طرق غير موسومة إشعاعيا. يمكن تحقيق وضع العلامات الإشعاعية للأجسام المضادة عن طريق التعديل الكيميائي المباشر للأجسام المضادة مع النويدات المشعة التي تشكل روابط تساهمية مستقرة (مثل اليود المشع) ، أو بشكل غير مباشر عن طريق الاقتران مع المخلبات التي تنسق لاحقا مع المعادن المشعة 7,8. وضع العلامات الإشعاعية المباشرة مثل اليود المشع يعدل على وجه التحديد التيروزين وبقايا الهيستيدين على الجسم المضاد. إذا كانت هذه المخلفات مهمة لربط المستضدات ، فإن هذا الاقتران الإشعاعي سيغير تقارب الربط. وعلى العكس من ذلك، هناك العديد من البروتوكولات المعمول بها للاقتران ووضع العلامات الإشعاعية غير المباشرة للأجسام المضادة. على سبيل المثال ، المخلب الشائع المستخدم لربط الزركونيوم-89 (89Zr) لتصوير PET للأجسام المضادة هو p-isothiocyanatobenzyl-desferrioxamine (DFO) ، والذي يقترن عشوائيا ببقايا ليسين من الجسم المضاد 9,10. إذا كانت هناك بقايا ليسين في منطقة ربط المستضدات ، فإن الاقتران في هذه المواقع يمكن أن يعيق ارتباطا بالمستضد بشكل معقم وبالتالي يعرض ربط الأجسام المضادة بالمستضدات للخطر. وبالتالي ، فإن طرق الاقتران الإشعاعي المختلفة المستخدمة في وضع العلامات الإشعاعية غير المباشرة أو المباشرة للأجسام المضادة يمكن أن تؤثر على التفاعل المناعي ، والذي يعرف بأنه قدرة الاقتران الإشعاعي للأجسام المضادة على الارتباط بمستضده 7,11. يمكن لطرق الاقتران الخاصة بالموقع التحايل على هذا القيد ، ولكن هذه التقنيات تتطلب هندسة الأجسام المضادة لدمج بقايا السيستين الإضافية أو الخبرة في التفاعلات الأنزيمية على بقايا الكربوهيدرات12،13،14،15،16. بمجرد وضع علامة إشعاعية على الجسم المضاد ، من المهم اختبار ما إذا كان يتم الاحتفاظ بالتفاعل المناعي كجزء من توصيف rAb. تتمثل إحدى طرق قياس التفاعل المناعي في تحديد التقارب الملزم ل rAb.
الغرض من هذا البروتوكول هو وصف عملية لتحديد التقارب الملزم ل rAbs باستخدام اختبار تشبع راديوي ثابت لتحديد ارتباط مستضد rAb. ويرد في الشكل 1 بيان بالاتجاه الملزم. ستزداد كمية المستضد المرتبط مع إضافة المزيد من rAb إلى كمية ثابتة من المستضد المجمد. بمجرد تشبع جميع مواقع ربط المستضدات ، سيتم الوصول إلى هضبة ، ولن يكون لإضافة المزيد من rAbs أي تأثير على كمية المستضد المرتبط. في هذا النموذج ، ثابت تفكك التوازن (KD) هو تركيز الجسم المضاد الذي يشغل نصف مستقبلات المستضد17. يمثل K D مدى ارتباط الجسم المضاد بهدفه مع KD أقل يتوافق مع تقارب ربط أعلى. وقد أفيد سابقا أن rAb المثالي يجب أن يكون KD من 1 نانومولار أو أقلمن 18. ومع ذلك ، تم تطوير rAbs أحدث مع KD في نطاق نانومولار منخفض ، وتعتبر مناسبة لتطبيقات التصوير غير الباضعة19،20،21،22. معلمة أخرى يمكن تحديدها في اختبار التشبع الإشعاعي ل rAbs هي Bmax ، والتي تتوافق مع الحد الأقصى لكمية ربط المستضدات. يمكن استخدام Bmax لحساب عدد جزيئات المستضد إذا لزم الأمر.
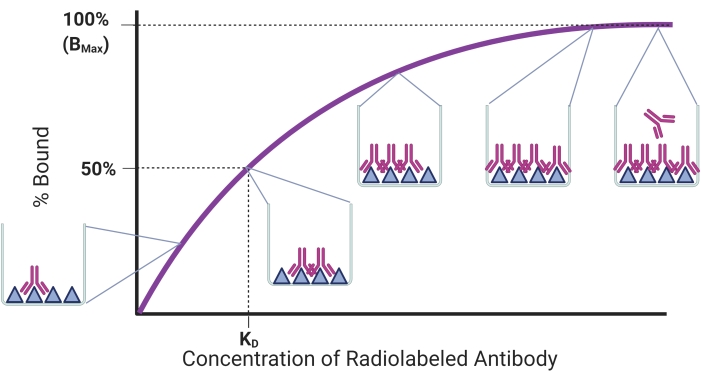
الشكل 1: منحنى ربط التشبع التمثيلي. يتم رسم النسبة المئوية للمستضد المرتبط مقابل زيادة تركيزات الأجسام المضادة المضافة إلى كمية ثابتة من المستضد. تظهر النوافذ المنبثقة أنها ملزمة في نقاط مختلفة. يتم عرض التركيز والربط المقابل ل KD و Bmax ، على التوالي. تم إنشاء هذا الرقم مع BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
هذا الفحص مهم بشكل خاص لبنى الأجسام المضادة ثنائية النوعية ذات العلامات الإشعاعية لتحديد KD لكل ذراع منطقة ربط مستضد شظايا (Fab) من الجسم المضاد ثنائي النوعية الموسوم إشعاعيا مع المستضدات الخاصة به. يمكن استخدام هذا البروتوكول لتحديد KD لكل ذراع Fab على حدة على المستضدات المجمدة لتحديد ما إذا كان التقارب الملزم لكل ذراع Fab للمستضد الخاص به قد تأثر بشكل مستقل بعد الاقتران الإشعاعي. ويتضح هذا البروتوكول من خلال استخدام أميفانتاماب المسمى إشعاعيا، وهو جسم مضاد ثنائي النوعية لمستقبلات عامل نمو البشرة (EGFR) وبروتينات الانتقال الوسيط الظهاري السيتوبلازمي (cMET)19. كما استخدمت كأمثلة19 الأجسام المضادة أحادية الذراع المصنفة إشعاعيا، حيث يرتبط أحد أذرع Fab ب EGFR (α-EGFR) أو ب cMET (α-cMET) وذراع Fab الآخر هو عنصر تحكم متساوي النوع. هذا البروتوكول مناسب أيضا لأي جسم مضاد يحمل علامة إشعاعية مع مستضد معروف يمكن شل حركته. في هذا البروتوكول ، تتم إضافة سلسلة تخفيف من rAb إلى كمية ثابتة من المستضد المثبت في آبار معينة محددة لكل ذراع Fab من rAb. يضاف rAb أيضا إلى الآبار التي تم حظرها فقط باستخدام ألبومين مصل البقر (BSA) ، بدون مستضد ، لتحديد الارتباط غير المحدد. لتحديد الربط المحدد ، يتم طرح الربط غير المحدد للمستضد المعطل من إجمالي ربط rAb. ثم يتم استخدام منحنى ربط التشبع الناتج لتحديد KD ، كما هو موضح أعلاه.
تتمثل إحدى مزايا هذه الطريقة في زيادة قابلية التكرار عند استخدام المستضدات النقية مقارنة باستخدام خطوط الخلايا كمصدر للمستضدات ، بالنظر إلى أن مستويات التعبير عن المستضدات يمكن أن تتأثر أثناء زراعة الخلايا وأن خطوط الخلايا المختلفة لها مستويات متغيرة من تعبير المستضد. في حالة الأجسام المضادة ثنائية النوعية ذات العلامات المشعة ، قد لا تتوفر خطوط الخلايا التي تعبر فقط عن أحد المستضدات دون الآخر ، مما يجعل توصيف التقارب الملزم لأذرع Fab الفردية أمرا صعبا للغاية. ومن الجدير بالذكر أن الميزة الرئيسية لطريقة فحص التشبع الإشعاعي على الطرق غير الموسومة إشعاعيا هي التوصيف المحدد لتقارب ربط rAb دون مساهمة الجزء غير المقترن من rAb. على حد علم المؤلفين ، لا توجد حاليا تقنيات تنقية لفصل rAb عن الجسم المضاد الأم غير المقترن. وبالنظر إلى الحجم الصغير نسبيا للمخلب والنويدات المشعة، فإن مساهمتهما في الوزن الجزيئي الكلي لل rAb ضئيلة في كروماتوغرافيا استبعاد الحجم. وبالتالي ، فإن المنتج الناتج عن أي تقنية لوضع العلامات الإشعاعية هو دائما تقريبا خليط من rAb والجسم المضاد الأم غير المقترن. إن توصيف تقارب الربط باستخدام اختبار التشبع الموسوم إشعاعيا يضمن أن المنتج الذي يتم اختباره هو rAb فقط.
Protocol
Representative Results
Discussion
كجزء من تطوير rAbs ، من المهم التأكد من ارتباط rAb على وجه التحديد بهدفه بتقارب ربط عال. يمكن أن يفيد تحديد تقارب الارتباط ما إذا كان التفاعل المناعي ل rAb يتأثر بالاقتران الإشعاعي من خلال اختبار التشبع الإشعاعي باستخدام مستضد مجمد. يمكن استخدام تحديد ارتباط rAb ب BSA لتحديد الارتباط غير المحدد لق?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
يشكر المؤلفون 3D Imaging على إنتاج [89Zr] Zr-oxalate والدكتورة شيري مورس في Janssen Pharmaceuticals لتوفير الأجسام المضادة.
Materials
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
Riferimenti
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Ricerca sul cancro. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).

