Bepaling van bindingsaffiniteit (KD) van radioactief gelabelde antilichamen tegen geïmmobiliseerde antigenen
Summary
Hier wordt een methode beschreven om de bindingsaffiniteit (KD) van radioactief gelabelde antilichamen tegen geïmmobiliseerde antigenen te bepalen. KD is de evenwichtsdissociatieconstante die kan worden bepaald uit een verzadigingsbindingsexperiment door de totale, specifieke en niet-specifieke binding van een radioactief gelabeld antilichaam in verschillende concentraties aan zijn antigeen te meten.
Abstract
Het bepalen van bindingsaffiniteit (KD) is een belangrijk aspect van de karakterisering van radioactief gelabelde antilichamen (rAb). Typisch wordt bindingsaffiniteit weergegeven door de evenwichtsdissociatieconstante, KD, en kan worden berekend als de concentratie van antilichamen waarbij de helft van de antilichaambindingsplaatsen bij evenwicht bezet zijn. Deze methode kan worden gegeneraliseerd naar elk radioactief gelabeld antilichaam of andere eiwit- en peptidesteigers. In tegenstelling tot celgebaseerde methoden is de keuze van geïmmobiliseerde antigenen bijzonder nuttig voor het valideren van bindingsaffiniteiten na langdurige opslag van antilichamen, het onderscheiden van bindingsaffiniteiten van fragmentantigeenbindende regio (Fab) armen in bispecifieke antilichaamconstructies en het bepalen of er variabiliteit is in antigeenexpressie tussen verschillende cellijnen. Deze methode omvat het immobiliseren van een vaste hoeveelheid antigeen naar gespecificeerde putten op een breekbare 96-putplaat. Vervolgens werd de niet-specifieke binding in alle putten geblokkeerd met runderserumalbumine (BSA). Vervolgens werd de rAb in een concentratiegradiënt aan alle putten toegevoegd. Er werd gekozen voor een reeks concentraties om de rAb verzadiging te laten bereiken, d.w.z. een concentratie van antilichamen waarbij alle antigenen continu gebonden zijn door de rAb. In aangewezen putten zonder geïmmobiliseerd antigeen kan een niet-specifieke binding van de rAb worden bepaald. Door niet-specifieke binding af te trekken van de totale binding in de putten met geïmmobiliseerd antigeen, kan de specifieke binding van de rAb aan het antigeen worden bepaald. De KD van de rAb werd berekend uit de resulterende verzadigingsbindingscurve. Als voorbeeld werd bindingsaffiniteit bepaald met behulp van radioactief gelabelde amivantamab, een bispecifiek antilichaam voor epidermale groeifactorreceptor (EGFR) en cytoplasmatische mesenchymale-epitheliale overgang (cMET) eiwitten.
Introduction
Radioactief gelabelde antilichamen (rAb) hebben een verscheidenheid aan toepassingen in de geneeskunde. Hoewel de meerderheid in de oncologie wordt gebruikt als beeldvorming en therapeutische middelen, zijn er beeldvormingstoepassingen voor reumatologie-gerelateerde ontsteking, cardiologie en neurologie1. Imaging rAbs heeft een hoge gevoeligheid om laesies te detecteren en heeft het potentieel om te helpen bij de selectie van patiënten voor behandeling 2,3,4,5. Ze worden ook gebruikt voor therapie vanwege hun specificiteit voor hun respectieve antigenen. In een strategie die bekend staat als theranostica, wordt dezelfde rAb gebruikt voor zowel beeldvorming als behandeling6.
Idealiter is het antilichaam dat is gekozen voor radiolabeling een antilichaam waarvan al is bewezen dat het een hoge bindingsaffiniteit en specificiteit heeft met behulp van niet-radioactief gelabelde methoden. Radiolabeling van antilichamen kan worden bereikt via directe chemische modificatie van antilichamen met een radionuclide dat stabiele covalente bindingen vormt (bijv. radioactief jodium), of indirect via conjugatie met chelaatvormers die vervolgens coördineren met radiometalen 7,8. Directe radiolabeling zoals met radioactief jodium wijzigt specifiek tyrosine- en histidineresiduen op het antilichaam. Als deze residuen belangrijk zijn voor antigeenbinding, dan zou deze radioconjugatie de bindingsaffiniteit veranderen. Omgekeerd zijn er meerdere gevestigde protocollen voor de conjugatie en indirecte radiolabeling van antilichamen. Een veel voorkomende chelator die wordt gebruikt om zirkonium-89 (89Zr) te binden voor PET-beeldvorming van antilichamen is bijvoorbeeld de p-isothiocyanatobenzyl-desferrioxamine (DFO), die willekeurig wordt geconjugeerd aan lysineresiduen van het antilichaam 9,10. Als er lysineresiduen in het antigeenbindende gebied zijn, kan conjugatie op deze plaatsen sterisch de antigeenbinding belemmeren en daarom de antilichaam-antigeenbinding in gevaar brengen. De verschillende radioconjugatiemethoden die worden gebruikt voor indirecte of directe radiolabeling van antilichamen kunnen dus mogelijk de immunoreactiviteit beïnvloeden, gedefinieerd als het vermogen van het antilichaam radioconjugaat om te binden aan zijn antigeen 7,11. Locatiespecifieke conjugatiemethoden kunnen deze beperking omzeilen, maar deze technieken vereisen antilichaamtechnologie om extra cysteïneresiduen of expertise in enzymatische reacties op koolhydraatresiduen op te nemen 12,13,14,15,16. Zodra een antilichaam radioactief is gelabeld, is het belangrijk om te testen of immunoreactiviteit behouden blijft als onderdeel van de karakterisering van de rAb. Een manier om immunoreactiviteit te meten is het bepalen van de bindingsaffiniteit van de rAb.
Het doel van dit protocol is om een proces te beschrijven voor het bepalen van de bindingsaffiniteit voor rAbs met behulp van een gevestigde radioligand saturatietest om rAb-antigeenbinding te kwantificeren. De bindingstrend is weergegeven in figuur 1. De hoeveelheid antigeen gebonden zal toenemen naarmate meer rAb wordt toegevoegd aan een vaste hoeveelheid geïmmobiliseerd antigeen. Zodra alle antigeenbindplaatsen verzadigd zijn, zal een plateau worden bereikt en zal het toevoegen van meer rAbs geen effect hebben op de hoeveelheid gebonden antigeen. In dit model is de evenwichtsdissociatieconstante (KD) de concentratie van antilichamen die de helft van de antigeenreceptoren inneemt17. De KD geeft aan hoe goed een antilichaam zich bindt aan zijn doelwit met een lagere KD die overeenkomt met een hogere bindingsaffiniteit. Eerder werd gemeld dat een ideale rAb een KD van 1 nanomolair of minder18 zou moeten hebben. Recentere rAbs zijn echter ontwikkeld met KD in het lage nanomolaire bereik en worden geschikt geacht voor niet-invasieve beeldvormingstoepassingen 19,20,21,22. Een andere parameter die kan worden bepaald in de radioligand-verzadigingstest van rAbs is Bmax, wat overeenkomt met de maximale hoeveelheid antigeenbinding. Bmax kan worden gebruikt om het aantal antigeenmoleculen te berekenen indien nodig.
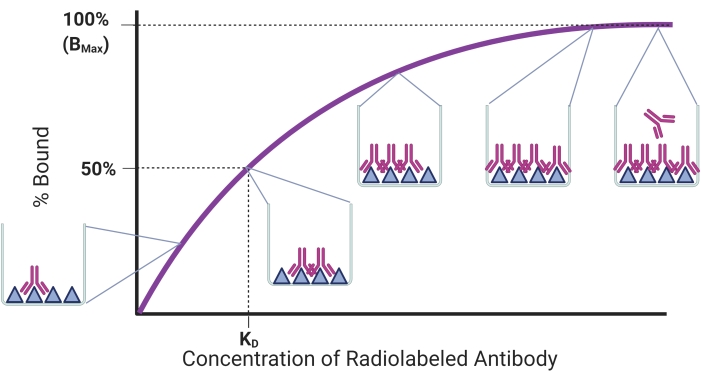
Figuur 1: Representatieve verzadigingsbindingscurve. Het percentage antigeen gebonden wordt uitgezet tegen toenemende concentraties antilichamen toegevoegd aan een vaste hoeveelheid antigeen. Pop-outs tonen binding op verschillende punten. De concentratie en binding die overeenkomen met respectievelijk KD en Bmax worden weergegeven. Deze figuur is gemaakt met BioRender.com. Klik hier om een grotere versie van deze figuur te bekijken.
Deze test is met name belangrijk voor radioactief gelabelde bispecifieke antilichaamconstructen om de KD te bepalen voor elke fragmentantigeenbindende regio (Fab) arm van de radioactief gelabelde bispecifieke antilichaambinding met hun respectieve antigenen. Dit protocol kan worden gebruikt om de KD van elke Fab-arm afzonderlijk op geïmmobiliseerde antigenen te bepalen om onafhankelijk te karakteriseren of de bindingsaffiniteit van elke Fab-arm voor zijn respectieve antigeen werd beïnvloed na radioconjugatie. Dit protocol wordt aangetoond door het gebruik van radioactief gelabelde amivantamab, een bispecifiek antilichaam voor epidermale groeifactorreceptor (EGFR) en cytoplasmatische mesenchymale-epitheliale overgang (cMET) eiwitten19. Radioactief gelabelde enkelarmige antilichamen, waarbij de ene Fab-arm bindt aan EGFR (α-EGFR) of aan cMET (α-cMET) en de andere Fab-arm een isotypecontrole is, werden ook gebruikt als voorbeelden19. Dit protocol is ook geschikt voor elk radioactief gelabeld antilichaam met een bekend antigeen dat kan worden geïmmobiliseerd. In dit protocol wordt een verdunningsreeks van de rAb toegevoegd aan een vaste hoeveelheid geïmmobiliseerd antigeen in aangewezen putten die specifiek zijn voor elke Fab-arm van de rAb. De rAb wordt ook toegevoegd aan putjes die alleen zijn geblokkeerd met runderserumalbumine (BSA), zonder antigeen, om niet-specifieke binding te bepalen. Om de specifieke binding te bepalen, wordt de niet-specifieke binding aan geïmmobiliseerd antigeen afgetrokken van de totale rAb-binding. De resulterende verzadigingsbindingscurve wordt vervolgens gebruikt om KD te bepalen, zoals hierboven beschreven.
Een voordeel van deze methode is een hogere reproduceerbaarheid bij het gebruik van gezuiverde antigenen in vergelijking met het gebruik van cellijnen als bron van antigenen, aangezien antigeenexpressieniveaus kunnen worden beïnvloed tijdens celkweek en dat verschillende cellijnen variabele niveaus van antigeenexpressie hebben. In het geval van radioactief gelabelde bispecifieke antilichamen zijn cellijnen die slechts één van de antigenen tot expressie brengen zonder de andere mogelijk niet beschikbaar, wat het karakteriseren van de bindingsaffiniteit van de individuele Fab-armen zeer uitdagend zou maken. Met name het belangrijkste voordeel van de radioligand saturatie-assaymethode ten opzichte van niet-radioactief gelabelde methoden is de specifieke karakterisering van de bindingsaffiniteit van de rAb zonder de bijdrage van de niet-geconjugeerde fractie van de rAb. Voor zover de auteurs weten, zijn er momenteel geen zuiveringstechnieken om de rAb te scheiden van zijn oorspronkelijke ongeconjugeerde antilichaam. Gezien de relatief kleine omvang van de chelator en radionuclide is hun bijdrage aan het totale molecuulgewicht van de rAb onbeduidend in grootte-uitsluitingschromatografie. Het product dat wordt gegenereerd door een radiolabelingstechniek is dus bijna altijd een mengsel van de rAb en het oorspronkelijke niet-geconjugeerde antilichaam. Het karakteriseren van bindingsaffiniteit met behulp van de radioactief gelabelde verzadigingstest zorgt ervoor dat het geteste product uitsluitend de rAb is.
Protocol
Representative Results
Discussion
Als onderdeel van de ontwikkeling van rAbs is het belangrijk om ervoor te zorgen dat een rAb specifiek bindt aan zijn doel met een hoge bindingsaffiniteit. Het bepalen van de bindingsaffiniteit kan aangeven of de immunoreactiviteit van de rAb wordt beïnvloed door radioconjugatie via de radioligand saturatietest met behulp van geïmmobiliseerd antigeen. Het bepalen van de rAb-binding aan BSA kan worden gebruikt om niet-specifieke binding te kwantificeren om de specifieke binding aan het geïmmobiliseerde antigeen nauwkeu…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
De auteurs bedanken 3D Imaging voor de productie van [89Zr]Zr-oxalaat en Dr. Sheri Moores van Janssen Pharmaceuticals voor het leveren van antilichamen.
Materials
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
Riferimenti
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Ricerca sul cancro. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).

