Dynamic électrochimique Mesure des ions chlorure
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
Un capteur d'ions chlorure par rapport à la mesure du temps de transition d'une électrode Ag / AgCl est présentée. Le but est d'éviter les dérives inhérentes au cours de la surveillance continue à long terme des ions chlorure dans l'électrolyte. Chronopotentiometric mesure, qui est une méthode de mesure dynamique, d'une électrode Ag / AgCl est utilisé à cet effet. Ici, un taux de variation du potentiel d'une électrode Ag / AgCl est mesurée pendant une impulsion (impulsion galvanostatique). L'avantage de cette approche est démontrée en éludant l'électrode de référence liquide jonction et à la place utiliser un fil métallique comme électrode pseudo-référence, permettant ainsi la détection de CL concentration des ions de long terme (années) et dans des applications in situ, comme mesure à l'intérieur de structures en béton.
Les ions chlorure dans les structures en béton est l'une des principales causes de la dégradation de 1,2. Il initie la corrosion par piqûres dans le renforcement en acier d'unrésultats ème à l'échec final de la structure 3. Par conséquent, la mesure des ions Cl dans le béton est inévitable de prévoir le cycle de vie du service et la maintenance d'une structure 4,5. Des principes de détection différents ont été rapportés pour la mesure des ions chlorures dans le béton comme électrochimique 6,7, 8,9 optique et électromagnétique 10,11. Cependant, les méthodes optiques et électromagnétiques ont des configurations volumineuses, sont difficiles à intégrer en tant que système autonome et avoir des problèmes avec la sélectivité 12. Dans la technique électrochimique, la mesure potentiométrique d'une électrode Ag / AgCl est l'état de la 6,7,13 d'approche de l'art. Malgré des résultats prometteurs, cette approche est limitée à la mesure l'échelle du laboratoire depuis les dérives de potentiel de référence et de diffusion des résultats de baisse potentielle des données erronées 14,15. Une approche de temps de transition basée sur la mesure électrochimique dynamique (DEM) pourrait atténuer le problème en raison du potentieldériver 16.
Dans le DEM, la réponse d'un système à un stimulus appliqué est mesurée 17-19. L'exemple d'un tel système est la chronopotentiométrie. Ici, une impulsion de courant appliquée est utilisée comme stimulus d'appauvrissement d'ions à proximité de la surface de l'électrode et la réponse mesurée est le potentiel correspondant. Un courant anodique à une électrode Ag / AgCl initie une réaction faradique (Ag + cl 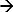 AgCl + e) qui entraîne une diminution des ions Cl près de la surface de l'électrode. La variation de potentiel est fonction du courant appliqué et de la concentration des ions sélectifs (12,20) dans l'électrolyte. Le moment où ces ions épuiser complètement proximité de l'électrode de surface le taux de variation de la hausse potentiels rapidement, donnant un point 21 d'inflexion. Le point sur la courbe de réponse en temps potentiel (chronopotentiogramme) inflexion indique le temps de transition et peut être déterminée à partir de lamaximale de la première dérivée de la réponse potentielle 22. Le temps de transition est une caractéristique de la concentration en ions. Cette approche a été utilisée pour déterminer la concentration des ions différents 17 et le pH des électrolytes 23,24. Dans le cas d'une électrode Ag / AgCl en tant qu'électrode de travail (dans laquelle le courant est appliqué) appauvrissant les ions seront ions chlorure 17. mesure donc sa date de transition permettra de déterminer sa concentration.
AgCl + e) qui entraîne une diminution des ions Cl près de la surface de l'électrode. La variation de potentiel est fonction du courant appliqué et de la concentration des ions sélectifs (12,20) dans l'électrolyte. Le moment où ces ions épuiser complètement proximité de l'électrode de surface le taux de variation de la hausse potentiels rapidement, donnant un point 21 d'inflexion. Le point sur la courbe de réponse en temps potentiel (chronopotentiogramme) inflexion indique le temps de transition et peut être déterminée à partir de lamaximale de la première dérivée de la réponse potentielle 22. Le temps de transition est une caractéristique de la concentration en ions. Cette approche a été utilisée pour déterminer la concentration des ions différents 17 et le pH des électrolytes 23,24. Dans le cas d'une électrode Ag / AgCl en tant qu'électrode de travail (dans laquelle le courant est appliqué) appauvrissant les ions seront ions chlorure 17. mesure donc sa date de transition permettra de déterminer sa concentration.
Protocol
Representative Results
Discussion
Le temps de transition est le moment de flexion; il est théoriquement indépendant du ie potentiel de référence, l'électrode de référence. Par conséquent, tout fil métallique peut être utilisé comme une électrode de pseudo-référence pour les mesures de temps de transition. Contrairement à la mesure potentiométrique existant d'ions chlorures dans le béton ce procédé permet une longue durée et sans étalonnage mesure. En outre, la sensibilité et la plage de détection de concentration …
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

