Dynamische elektrochemischen Messung von Chlorid-Ionen
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
Eine Chloridionensensor auf der Basis des Übergangszeitmessung einer Ag / AgCl-Elektrode dargestellt. Das Ziel ist es, die inhärenten Driften während des langfristigen kontinuierlichen Überwachung der Chloridionen in dem Elektrolyten zu vermeiden. Chronopotentiometrischen Messung, die eine dynamische Messung Ansatz ist, einer Ag / AgCl-Elektrode ist zu diesem Zweck verwendet. Hier ist eine Änderungsrate des Potentials einer Ag / AgCl-Elektrode ist während eines Stimulus (galvanostatischen Impuls) gemessen. Der Vorteil dieses Ansatzes ist durch entzieht die Flüssigkeit-Übergang Referenzelektrode nachgewiesen und stattdessen unter Verwendung jeder Metalldraht als Pseudoreferenzelektrode, ermöglicht so den Nachweis von Cl-Ionen-Konzentration für langfristige (Jahre) und in situ-Anwendungen, wie beispielsweise Messung in Betonkonstruktionen.
Chloridionen in Betonstrukturen ist eine der wichtigsten Ursachen der Verschlechterung 1,2. Es initiiert Lochfraß in der Bewehrungsstahl einnd Ergebnisse in der endgültigen Versagen der Struktur 3. Daher Ionen in Beton Cl Messung unvermeidlich die Lebensdauer und Wartungszyklus einer Struktur 4,5 vorherzusagen. Verschiedene Messprinzipien sind für Chloridionen Messung im Beton wie elektrochemische 6,7, optische 8,9 und elektromagnetische 10,11 ausgewiesen. Jedoch optische und elektromagnetische Methoden sperrige Aufbauten haben, sind schwierig als Stand-Alone-System zu integrieren und haben Probleme mit Selektivität 12. Bei elektrochemischen Technik, potentiometrischen Messung eines Ag / AgCl-Elektrode ist der Stand der Technik Ansatz 6,7,13. Trotz vielversprechender Ergebnisse ist dieser Ansatz zu Labormaßstab Messung, da die Antriebe in Bezug Potential und Diffusionsspannungsabfall führt zu fehlerhaften Daten 14,15 begrenzt. Eine Übergangszeit Ansatz basiert auf dem dynamischen elektrochemischen Messung (DEM) konnte das Problem wegen der möglichen lindernDrift 16.
In dem DEM wird eine Systemantwort auf eine angelegte Stimulus gemessen 17-19. Das Beispiel eines solchen Systems ist Chronopotentiometrie. Hier ein angelegter Stromimpuls wird als Stimulus verwendet, um Ionen in der Nähe der Elektrodenoberfläche abbauende und das entsprechende Potenzial Reaktion gemessen wird. Ein anodischer Strom bei einer Ag / AgCl-Elektrode leitet einen Faradayschen Reaktion (Ag + Cl 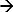 AgCl + E), was zu einer Verarmung von Cl-Ionen in der Nähe von Elektrodenoberfläche. Die Potentialänderung ist eine Funktion des angelegten Stroms und die Konzentration der (selektiven) -Ionen in der Elektrolyt 12,20. In dem Moment, diese Ionen verarmen vollständig in der Nähe der Elektrode schnell die Geschwindigkeit der Änderung des Potentials steigt die Oberfläche, was einen Wendepunkt 21. Der Wendepunkt auf dem Potential Zeitantwortkurve (chronopotentiogram) zeigt die Übergangszeit und kann von der bestimmt werdenMaximum der ersten Ableitung der Potentialantwort 22. Die Übergangszeit ist ein Merkmal der Ionenkonzentration. Dieser Ansatz ist verwendet worden 23,24 verschiedenen Ionen-Konzentration 17 und den pH-Wert von Elektrolyten zu bestimmen. Im Falle einer Ag / AgCl-Elektrode als Arbeitselektrode (zu dem Strom angelegt wird) die abbau Ionen Chloridionen 17 sein wird. Daher seine Übergangszeitmessung wird ihre Konzentration bestimmen.
AgCl + E), was zu einer Verarmung von Cl-Ionen in der Nähe von Elektrodenoberfläche. Die Potentialänderung ist eine Funktion des angelegten Stroms und die Konzentration der (selektiven) -Ionen in der Elektrolyt 12,20. In dem Moment, diese Ionen verarmen vollständig in der Nähe der Elektrode schnell die Geschwindigkeit der Änderung des Potentials steigt die Oberfläche, was einen Wendepunkt 21. Der Wendepunkt auf dem Potential Zeitantwortkurve (chronopotentiogram) zeigt die Übergangszeit und kann von der bestimmt werdenMaximum der ersten Ableitung der Potentialantwort 22. Die Übergangszeit ist ein Merkmal der Ionenkonzentration. Dieser Ansatz ist verwendet worden 23,24 verschiedenen Ionen-Konzentration 17 und den pH-Wert von Elektrolyten zu bestimmen. Im Falle einer Ag / AgCl-Elektrode als Arbeitselektrode (zu dem Strom angelegt wird) die abbau Ionen Chloridionen 17 sein wird. Daher seine Übergangszeitmessung wird ihre Konzentration bestimmen.
Protocol
Representative Results
Discussion
Die Übergangszeit ist der Moment der Einbiegung; es ist theoretisch unabhängig von dem Bezugspotential dh der Referenzelektrode. Daher ist jede Metalldraht kann für Übergangszeitmessungen als Pseudo-Referenzelektrode benutzt werden. Im Gegensatz zu den bestehenden potentiometrischen Messung von Chloridionen in Beton ermöglicht dieses Verfahren eine langfristige und Kalibrierung freie Messung. Weiterhin ist die Empfindlichkeit und die Nachweiskonzentrationsbereich kann durch Einstellen der angelegten Stromi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

