염화물 이온의 동적 전기 측정
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
의 Ag / AgCl을 전극의 천이 시간 측정에 기초하여 염소 이온 센서가 제공된다. 목적은 전해질의 염화물 이온의 장기간의 연속 모니터링 동안 고유 드리프트를 방지한다. 의 Ag / AgCl을 전극의 동적 측정 방법이다 Chronopotentiometric 측정은이 목적을 위해 사용된다. 여기에서의 Ag / AgCl을 전극의 전위 변화율은 자극 (정전류 펄스) 동안 측정한다. 이 방법의 장점은 다음과 같은 반응계 애플리케이션 따라서 장기 (10 세)에 대한 CL 이온 농도의 검출을 허용 액체 접합 기준 전극을 벗어난 대신에 의사 – 기준 전극으로서 금속 와이어를 이용하여 이상에서 설명된다 콘크리트 구조물 내부 측정.
콘크리트 구조물의 염화물 이온을 분해 1, 2의 주요 원인 중 하나입니다. 이것은 전기자 부식 내공 동수구조 (3)의 궁극적 인 실패에 차 결과. 따라서, 콘크리트 CL 이온을 측정하는 구조 -4,5-의 수명 및 유지 보수 사이클을 예측 불가피하다. 다른 검출 원리는 전기 -6,7- 광학 8,9 전자기 10,11 콘크리트 염화 이온 측정보고되었다. 그러나 부피가 큰 설정을 광학 및 전자 기적 방법, 독립형 시스템으로 통합하고, 선택 12 문제가 어렵다. 전기 화학적 기술에서의 Ag / AgCl을 전극의 전위차 측정은 당해 접근 6,7,13의 상태이다. 유망한 결과에도 불구하고,이 방법은 결함 데이터 (14, 15)의 기준 전위와 확산 전위 강하 결과 드리프트 보낸 실험실 규모의 측정으로 제한된다. 동적 측정 전기 (DEM)에 기초하여 전이 시간 방식으로 인해 잠재적으로 문제를 완화 할 수16 드리프트.
DEM에서 적용 자극에 대한 시스템의 응답은 17 ~ 19을 측정한다. 이러한 시스템의 예는 chronopotentiometry이다. 여기에인가되는 전류 펄스는 전극의 표면 부근의 이온 고갈 자극으로서 사용하고 대응하는 전위 반응을 측정한다. 의 Ag / AgCl을 전극에 양극 전류는 패러데이 반응을 시작은 (Ag + CL 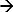 전극 표면 부근 CL 이온의 고갈을 초래 AgCl을 + 전자). 전위 변화는인가되는 전류의 기능과 전해질 (12, 20)의 (선택적) 이온의 농도이다. 이러한 이온들은 전극 부근 완전히 고갈 순간 변곡점 (21)을 제공 빠르게 전위 상승의 변화율 표면. 잠재적 시간 반응 곡선 (chronopotentiogram)의 변곡점 전이 시간을 도시로부터 결정될 수있다전위 반응 (22)의 1 차 도함수의 최대. 전이 시간은 이온 농도의 특성이다. 이 방법은 다른 이온 농도 (17)와 전해질 (23, 24)의 pH를 결정하는 데 사용되었다. 작동 전극으로의 Ag / AgCl을 전극의 경우 고갈 이온은 염화물 이온 17 것이다 (전류가인가된다). 따라서, 그 농도를 측정 할 그 천이 시간 측정.
전극 표면 부근 CL 이온의 고갈을 초래 AgCl을 + 전자). 전위 변화는인가되는 전류의 기능과 전해질 (12, 20)의 (선택적) 이온의 농도이다. 이러한 이온들은 전극 부근 완전히 고갈 순간 변곡점 (21)을 제공 빠르게 전위 상승의 변화율 표면. 잠재적 시간 반응 곡선 (chronopotentiogram)의 변곡점 전이 시간을 도시로부터 결정될 수있다전위 반응 (22)의 1 차 도함수의 최대. 전이 시간은 이온 농도의 특성이다. 이 방법은 다른 이온 농도 (17)와 전해질 (23, 24)의 pH를 결정하는 데 사용되었다. 작동 전극으로의 Ag / AgCl을 전극의 경우 고갈 이온은 염화물 이온 17 것이다 (전류가인가된다). 따라서, 그 농도를 측정 할 그 천이 시간 측정.
Protocol
Representative Results
Discussion
전이 시간은 굴곡 모멘트이고; 그 기준 전위, 즉, 상기 기준 전극의 이론적 독립적이다. 따라서 금속 와이어 천이 시간 측정 유사 기준 전극으로 사용할 수있다. 콘크리트 염화물 이온의 존재 전위차 측정 대조적으로이 방법은 장기 및 교정 무료 측정 할 수있다. 또한, 감도 및 농도의 검출 범위는인가되는 전류 펄스를 조정함으로써 조정될 수있다. 콘크리트 대소 CL 높은 농도의 경우, 높은 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

