Klorür iyonlarının Dinamik Elektrokimyasal Ölçüm
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
bir Ag / AgCİ elektrot geçiş süresi ölçümüne dayalı bir klorür iyonu sensörü sunulmuştur. Amaç elektrolit klorid iyonlarının uzun süreli kesintisiz izleme sırasında içsel kaymalan kaçınmaktır. bir Ag / AgCİ elektrot dinamik ölçüm yaklaşımdır Chronopotentiometric ölçümü, bu amaç için kullanılır. Burada, bir Ag / AgCİ elektrot potansiyeli değişim oranı bir uyarıcı (galvanostatik darbe) içinde ölçülür. Bu yaklaşımın avantajı, örneğin, in situ uygulama bu nedenle, uzun dönemli (y) Cl iyonları konsantrasyonunun saptanmasını sağlayan sıvı bileşke referans elektrot eluding ve bunun yerine bir sözde bir referans elektrot olarak metal tel kullanılarak ve gösterilmiştir beton yapıların içindeki ölçüm.
Beton yapılarda klorür iyonları bozulma 1,2 başlıca nedenlerinden biridir. Bu destek sacı a'daki korozyona başlatırYapı 3'e ait nihai yetmezliğinde nd sonuçlanır. Bu nedenle, betonda cl iyonları ölçebilen bir yapı 4,5'ten ömrü ve bakım döngüsü tahmin etmek kaçınılmazdır. Farklı algılama prensipleri gibi elektrokimyasal 6,7, optik 8,9 ve elektromanyetik 10,11 olarak betonda klorür iyonu ölçümü için rapor edilmiştir. Ancak, hantal kurulumları sahip optik ve elektromanyetik yöntemler, tek başına bir sistem olarak entegre ve seçicilik 12 ile ilgili sorunlar var zordur. Elektrokimyasal teknikte, bir Ag / AgCl elektrot potansiyometrik ölçüm sanat yaklaşımı 6,7,13 durumudur. Umut verici sonuçlara rağmen, bu yaklaşım hatalı veriler 14,15 referans potansiyeli ve difüzyon potansiyeli damla sonuçlarında sürükleniyor beri laboratuvar ölçekli ölçümü ile sınırlıdır. Dinamik elektrokimyasal ölçüm (DEM) dayalı bir geçiş süresi yaklaşımı nedeniyle olası sorunu hafifletebilir16 drift.
DEM olarak, uygulanan bir uyarıya bir sistemin tepkisi 17-19 ölçülür. Bu tür bir sistemin bir örnek kronopotansiyometri olup. Burada uygulanan akım darbesi elektrot yüzeyine yakın iyonları tüketen bir uyarıcı olarak kullanılır ve buna karşılık gelen, potansiyel yanıtı ölçülmektedir. bir Ag / AgCI elektrotta bir anodik akım Faradaysal reaksiyonu başlatır (Ag + CI 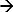 elektrod üst yüzeyi yakınındaki Cl iyonu tükenişine elde AgCİ + E). Potansiyel bir değişikliği uygulanan akımın bir fonksiyonu ve elektrolit 12,20'den bölgesindeki (seçmeli) iyonlarının konsantrasyonudur. Bu iyonlar elektrot yakınlarında tamamen tüketmek an bir dönüm noktası 21 vererek, hızla potansiyel yükselir değişim oranını yüzey. Potansiyel zamanlı tepki eğrisi (chronopotentiogram) üzerine dönüm noktası geçiş süresini gösterir ve belirlenebilirPotansiyel tepki 22 birinci türevinin maksimum. geçiş süresi iyonu konsantrasyonunun bir özelliğidir. Bu yaklaşım, farklı iyonları konsantrasyonu 17 ve elektrolitlerin 23,24 pH belirlemek için kullanılır olmuştur. Bir çalışma elektrotu olarak bir Ag / AgCİ elektrot halinde tüketen iyonları klorür iyonları 17 olacaktır (bu, hangi uygulanır). Bu nedenle onun konsantrasyonunu belirlemek edecek olan geçiş süresi ölçülerek.
elektrod üst yüzeyi yakınındaki Cl iyonu tükenişine elde AgCİ + E). Potansiyel bir değişikliği uygulanan akımın bir fonksiyonu ve elektrolit 12,20'den bölgesindeki (seçmeli) iyonlarının konsantrasyonudur. Bu iyonlar elektrot yakınlarında tamamen tüketmek an bir dönüm noktası 21 vererek, hızla potansiyel yükselir değişim oranını yüzey. Potansiyel zamanlı tepki eğrisi (chronopotentiogram) üzerine dönüm noktası geçiş süresini gösterir ve belirlenebilirPotansiyel tepki 22 birinci türevinin maksimum. geçiş süresi iyonu konsantrasyonunun bir özelliğidir. Bu yaklaşım, farklı iyonları konsantrasyonu 17 ve elektrolitlerin 23,24 pH belirlemek için kullanılır olmuştur. Bir çalışma elektrotu olarak bir Ag / AgCİ elektrot halinde tüketen iyonları klorür iyonları 17 olacaktır (bu, hangi uygulanır). Bu nedenle onun konsantrasyonunu belirlemek edecek olan geçiş süresi ölçülerek.
Protocol
Representative Results
Discussion
geçiş süresi bükülme andır; bu referans potansiyeli yani, referans elektrot teorik bağımsızdır. Bu nedenle, herhangi bir metal tel geçiş süresi ölçümleri için bir sözde referans elektrotu olarak kullanılabilir. Beton klorid iyonlarının mevcut potansiyometrik ölçüm aksine, bu yöntem, uzun süreli ve kalibrasyon serbest ölçüm sağlar. Üstelik duyarlılık ve konsantrasyon algılama aralığı uygulanan akım darbesi ayarlayarak ayarlanabilir. Betonda harf yüksek cl konsantrasyonları…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

