Dynamische elektrochemische meting van chloride-ionen
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
Een chloride-ion sensorgebaseerde op de overgang tijdmeting van een Ag / AgCl-elektrode wordt gepresenteerd. Doel is de inherente afwijkingen tijdens de langdurige continue bewaking van de chloride-ionen in de elektrolyt te voorkomen. Chronopotentiometric meting, die een dynamische meting benadering van een Ag / AgCl-elektrode wordt gebruikt voor dit doel. Hier een mate van verandering van vermogen van een Ag / AgCl elektrode wordt gemeten tijdens een stimulus (galvanostatische puls). Het voordeel van deze benadering is aangetoond door ontwijkt de vloeistof-junctie referentie-elektrode en in plaats daarvan gebruik van een metalen draad als een pseudo-referentie-elektrode, waardoor deze de detectie van Cl ionen concentratie lange tijd (jaren) en in situ toepassingen, zoals meting in betonconstructies.
Chloride-ionen in betonconstructies is een van de belangrijkste oorzaken van afbraak 1,2. Het initieert putcorrosie in het wapeningsstaal eennd resulteert in de uiteindelijke falen van de structuur 3. Daarom meten Cl ionen in beton is onvermijdelijk om de levensduur en onderhoudscyclus van een constructie 4,5 voorspellen. Verschillende detectie principes zijn gerapporteerd voor chloride-ionen meting beton zoals elektrochemische 6,7, 8,9 optische en elektromagnetische 10,11. Echter, optische en elektromagnetische methoden volumineuze opstellingen, moeilijk te integreren als zelfstandig systeem en problemen met selectiviteit 12 hebben. In elektrochemische techniek potentiometrische meting van een Ag / AgCl-elektrode is de stand van de techniek aanpak 6,7,13. Ondanks veelbelovende resultaten, deze benadering is beperkt tot laboratoriumschaal meten aangezien de afwijkingen in referentiepotentiaal en verspreiding potentiaaldaling leidt tot gebrekkige gegevens 14,15. Een overgangstijd aanpak op basis van de dynamische elektrochemische meting (DEM) kan het probleem verminderen als gevolg van mogelijkedrift 16.
In de DEM, is de reactie van een systeem om een toegepaste prikkel gemeten 17-19. Het voorbeeld van een dergelijk systeem is chronopotentiometry. Hier een toegepaste stroompuls wordt gebruikt als een stimulans afbrekende ionen nabij het elektrodeoppervlak en de bijbehorende potentiaal respons wordt gemeten. Een anodische stroom bij een Ag / AgCl-elektrode initieert een Faraday-reactie (Ag + CL 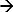 AgCl + E) resulteert in een uitputting van de CL-ionen in de buurt van de elektrode oppervlak. De potentiële is een functie van de toegepaste stroom en de concentratie van de (selectieve) -ionen in het elektrolyt 12,20. Momenteel deze ionen afbreken volledig de elektroden oppervlak de veranderingssnelheid potentiële stijgt snel, waardoor een buigpunt 21. Het buigpunt op de potentiaalvrije time respons curve (chronopotentiogram) geeft de overgangstijd en kan worden bepaald uit demaximum van de eerste afgeleide van de potentiële respons 22. De overgangstijd is een kenmerk van de ionenconcentratie. Deze benadering is gebruikt om verschillende ionen concentratie 17 en de pH van elektrolyten 23,24 bepalen. Bij een Ag / AgCl-elektrode als werkelektrode (waaraan stroom wordt toegepast) het afbreken ionen zullen chloorionen 17. Daarom is het meten van de overgangstijd zal zijn concentratie te bepalen.
AgCl + E) resulteert in een uitputting van de CL-ionen in de buurt van de elektrode oppervlak. De potentiële is een functie van de toegepaste stroom en de concentratie van de (selectieve) -ionen in het elektrolyt 12,20. Momenteel deze ionen afbreken volledig de elektroden oppervlak de veranderingssnelheid potentiële stijgt snel, waardoor een buigpunt 21. Het buigpunt op de potentiaalvrije time respons curve (chronopotentiogram) geeft de overgangstijd en kan worden bepaald uit demaximum van de eerste afgeleide van de potentiële respons 22. De overgangstijd is een kenmerk van de ionenconcentratie. Deze benadering is gebruikt om verschillende ionen concentratie 17 en de pH van elektrolyten 23,24 bepalen. Bij een Ag / AgCl-elektrode als werkelektrode (waaraan stroom wordt toegepast) het afbreken ionen zullen chloorionen 17. Daarom is het meten van de overgangstijd zal zijn concentratie te bepalen.
Protocol
Representative Results
Discussion
De overgang is het moment van de verbuiging; het theoretisch onafhankelijk van de referentiepotentiaal dwz, de referentie-elektrode. Derhalve geen metalen draad kan worden gebruikt als een pseudo-referentie-elektrode voor overgangstijd metingen. In tegenstelling tot de bestaande potentiometrische meting van chloride-ionen in beton maakt deze werkwijze een langdurige en ijking meting. Bovendien de gevoeligheid en het detectiebereik van concentratie kan worden ingesteld door aanpassing van de toegepaste stroompul…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

