מדידת אלקטרוכימיות הדינמית של יוני כלוריד
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
חיישן יון כלוריד המבוסס על מדידת זמן מעבר של אלקטרודת Ag / AgCl מוצג. המטרה היא למנוע את נסחפת הטמון במהלך ניטור רציף לטווח ארוך של יוני כלוריד ב האלקטרוליט. מדידת Chronopotentiometric, אשר הוא גישת מדידה דינמית, של אלקטרודת Ag / AgCl משמשת למטרה זו. הנה בשיעור שינוי של פוטנציאל של אלקטרודת Ag / AgCl נמדד במהלך גירוי (דופק galvanostatic). היתרון של גישה זו בא לידי הביטוי כשהיא עוקפת את האלקטרודה ההתייחסות נוזלת צומת ובמקום באמצעות כל חוט מתכת כמו אלקטרודה פסאודו-התייחסות, ובכך מאפשר זיהוי של ריכוז יוני CL עבור (שנים) לטווח ארוך ביישומים באתרו, כגון מדידה בתוך מבני בטון.
יוני כלוריד מבני בטון הוא אחד הגורמים העיקריים של 1,2 השפלה. הוא יוזם הצבת קורוזיה פלדה חיזוקתוצאות nd בכישלון האולטימטיבי של מבנה 3. לכן, מדידת יוני CL בבטון היא בלתי נמנעת כדי לחזות את מחזור החיים ותחזוקה של 4,5 מבנה. עקרונות חישה שונים דווחו למדידת וכלוריד בטון כגון 6,7 אלקטרוכימיים, אופטי 8,9 ו 10,11 אלקטרומגנטית. עם זאת, שיטות אופטיות אלקטרומגנטית יש setups מגושם, קשה לשלב כמערכת עצמאית ויש לי בעיות עם הסלקטיביות 12. בטכניקה אלקטרוכימיים, מדידה פוטנציומטרית של אלקטרודת Ag / AgCl היא המצב של 6,7,13 גישת אמנות. למרות תוצאות מבטיחות, הגישה זו היא מוגבלת מדידה בקנה מידת מעבדה מאז המרחף בפוטנציאל התייחסות ותוצאות נשירות דיפוזיה בנתונים פגומים 14,15. גישה בזמן מעבר המבוססת על מדידת אלקטרוכימיים הדינמי (DEM) יכולה להקל על בעיה בשל פוטנציאללהיסחף 16.
ב DEM, התגובה של מערכת לגירוי להחיל נמדדת 17-19. הדוגמא של מערכת כזו היא chronopotentiometry. הנה דופק נוכחי להחיל משמש כגירוי ומכלת יונים ליד פני האלקטרודה ואת תגובת הפוטנציאל המתאימה נמדדת. זרם anodic ב אלקטרודה Ag / AgCl יוזם תגובה faradaic (Ag + Cl 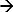 AgCl + E) וכתוצאה מכך דלדול של יוני CL ליד משטח האלקטרודה. השינוי הפוטנציאלי הוא פונקציה של הזרם שיושם הריכוז של היונים (סלקטיבית) ב 12,20 אלקטרוליט. ברגע יונים אלה לרוקן לחלוטין ליד האלקטרודה פני שטח שיעור השינוי של עליות פוטנציאל במהירות, נותן נקודת פיתול 21. נקודת הפיתול על עקומת תגובת פוטנציאל האמת (chronopotentiogram) מראה את שעת המעבר וניתן לקבוע מןמרבי של הנגזרת הראשונה של תגובה פוטנציאל 22. שעת המעבר היא מאפיין של ריכוז היון. גישה זו נעשה שימוש כדי לקבוע ריכוז יונים שונים 17 ו pH של אלקטרוליטים 23,24. במקרה של אלקטרודת Ag / AgCl כמו אלקטרודה עבודה (שאליו נוכחי מוחל) יוני depleting יהיו יוני כלוריד 17. לכן מדידת זמן המעבר שלה יקבע ריכוזו.
AgCl + E) וכתוצאה מכך דלדול של יוני CL ליד משטח האלקטרודה. השינוי הפוטנציאלי הוא פונקציה של הזרם שיושם הריכוז של היונים (סלקטיבית) ב 12,20 אלקטרוליט. ברגע יונים אלה לרוקן לחלוטין ליד האלקטרודה פני שטח שיעור השינוי של עליות פוטנציאל במהירות, נותן נקודת פיתול 21. נקודת הפיתול על עקומת תגובת פוטנציאל האמת (chronopotentiogram) מראה את שעת המעבר וניתן לקבוע מןמרבי של הנגזרת הראשונה של תגובה פוטנציאל 22. שעת המעבר היא מאפיין של ריכוז היון. גישה זו נעשה שימוש כדי לקבוע ריכוז יונים שונים 17 ו pH של אלקטרוליטים 23,24. במקרה של אלקטרודת Ag / AgCl כמו אלקטרודה עבודה (שאליו נוכחי מוחל) יוני depleting יהיו יוני כלוריד 17. לכן מדידת זמן המעבר שלה יקבע ריכוזו.
Protocol
Representative Results
Discussion
שעת המעבר הוא רגע של פיתול; היא תיאורטית עצמאית של כלומר פוטנציאל התייחסות, אלקטרודה השוואתית. לכן כל חוט מתכת יכול לשמש אלקטרודה פסאודו התייחסות למדידות זמן המעבר. בניגוד יוני כלוריד פוטנציומטרית מדידת הקיים בבטון שיטה זו מאפשרת מדידה חינם לטווח ארוך וכיו…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

