Imaging Membraan Potentiële twee soorten genetisch gecodeerde Fluorescent Voltage Sensors
Summary
A method for imaging changes in membrane potential using genetically encoded voltage indicators is described.
Abstract
Genetically encoded voltage indicators (GEVIs) have improved to the point where they are beginning to be useful for in vivo recordings. While the ultimate goal is to image neuronal activity in vivo, one must be able to image activity of a single cell to ensure successful in vivo preparations. This procedure will describe how to image membrane potential in a single cell to provide a foundation to eventually image in vivo. Here we describe methods for imaging GEVIs consisting of a voltage-sensing domain fused to either a single fluorescent protein (FP) or two fluorescent proteins capable of Förster resonance energy transfer (FRET) in vitro. Using an image splitter enables the projection of images created by two different wavelengths onto the same charge-coupled device (CCD) camera simultaneously. The image splitter positions a second filter cube in the light path. This second filter cube consists of a dichroic and two emission filters to separate the donor and acceptor fluorescent wavelengths depending on the FPs of the GEVI. This setup enables the simultaneous recording of both the acceptor and donor fluorescent partners while the membrane potential is manipulated via whole cell patch clamp configuration. When using a GEVI consisting of a single FP, the second filter cube can be removed allowing the mirrors in the image splitter to project a single image onto the CCD camera.
Introduction
Het hoofddoel van dit artikel is het optische beeldvorming van veranderingen in membraanpotentialen in vitro gebruik van genetisch gecodeerde fluorescente proteïnen demonstreren. Imaging veranderingen in membraanpotentiaal biedt de spannende mogelijkheid bestuderen van de activiteit van neuronale circuits. Wanneer veranderingen in membraanpotentiaal resulteren in een verandering fluorescentie-intensiteit, elke pixel van de camera wordt een surrogaat elektrode waarmee nonintrusive metingen van neuronale activiteit. Al meer dan veertig jaar, hebben organische voltage-gevoelige kleurstoffen die bruikbaar zijn voor het observeren van de veranderingen in de membraanpotentiaal 1-4 geweest. Echter, deze kleurstoffen gebrek cellulaire specificiteit. Bovendien zijn sommige celtypen moeilijk te bevlekken. Genetisch gecodeerde spanningsindicatoren (GEVIs) deze beperkingen te ondervangen doordat de cellen specifiek te bestuderen drukken de fluorescerende spanningsgevoelige probe.
Er zijn drie klassen van GEVIs. De eerste klasse van GEVI maakt gebruik van de voltage-sensing domein van de spanning sensing fosfatase met ofwel een enkel fluorescerend eiwit (FP) 5-9 of een Förster resonance energy transfer (FRET) paar 10-12. De tweede klasse van sensoren maakt gebruik van microbiële rhodopsine als een fluorescerende indicator rechtstreeks 13-15 of via elektrochrome FRET 16,17. De derde klasse gebruikt twee componenten, de genetische component een membraan verankerd FP en een tweede component een membraan gebonden kleurstof 18-20 quenching. Terwijl de tweede en derde klassen zijn bruikbaar voor in vitro experimenten en slice 19,20, alleen de eerste klasse van sensoren zijn bruikbaar voor in vivo analyses 6.
In dit verslag wij de beeldvorming van membraanpotentiaal tonen met de eerste klasse van GEVIs (figuur 1) in vitro. Dit eersteklas spanningssensoren is het makkelijkst om de overgang in vivo beeldvorming. Sinds GEVIs utilizing een spanningsgestuurde sensing domein gefuseerd aan een FP zijn ongeveer 50 maal helderder dan de rhodopsine klasse van sensoren, kunnen worden afgebeeld met behulp booglamp verlichting plaats van dat een zeer krachtige laser. Een ander gevolg van het verschil in helderheid dat de eerste klasse van GEVIs gemakkelijk de auto-fluorescentie van de hersenen kan overschrijden. De rhodopsine gebaseerde probes kan niet. De derde klasse van sensor even helder als de eerste klasse, maar vereist de toevoeging van een chemisch quencher die moeilijk toe te dienen in vivo.
Wij demonstreren daarom het verkrijgen van een probe met één FP (Bongwoori) 8 en een probe bestaande uit een FRET paar (Nabi 2) 12. De FRET construeert in dit rapport zijn vlinder versies van VSFP-CR (voltage-gevoelige fluorescerende eiwitten – Clover-mRuby2) 11, bestaande uit een groen fluorescerend donor, Clover, en een rode fluorescerende acceptor, mRuby2, genaamd Nabi 2,242 en 2,244 Nabi <sup> 12. In de inleiding van dit soort opnamen moeten onderzoekers een beter begrip van het type informatie GEVIs kan verschaffen.
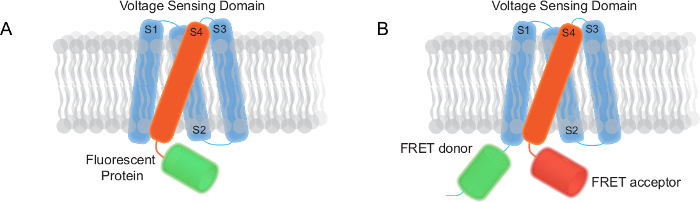
Figuur 1. Twee soorten genetisch gecodeerde Voltage Indicators (GEVIs) Bedrukte in dit rapport (A) Een mono FP gebaseerd GEVI met een trans-membraan-voltage sensing domein en een fluorescerend eiwit. (B) A FRET gebaseerd GEVI bestaat uit een trans-membraan-voltage sensing domein, een FRET donor en acceptor. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Het zenuwstelsel gebruikt spanning op verschillende manieren remming veroorzaakt een lichte hyperpolarisatie, synaptische ingang veroorzaakt een lichte depolarisatie en een actiepotentiaal leidt tot een relatief grote spanningsverandering. Het vermogen om veranderingen in membraanpotentiaal meten door GEVIs biedt het veelbelovend potentieel gelijktijdig analyseren van verschillende componenten van neuronale circuits. In dit rapport tonen we een fundamentele methode voor het afbeelden veranderingen in de membraanpotentia…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the World Class Institute (WCI) program of the National Research Foundation of Korea funded by Ministry of Education, Science, and Technology of Korea Grant WCI 2009-003 and Korea Institute of Science and Technology Institutional Program Project 2E24210. Sungmoo Lee was supported by Global Ph.D. Fellowship program (NRF-2013H1A2A1033344) of the National Research Foundation (NRF) under the Ministry of Education (MOE, Korea).
Materials
| Inverted Microscope | Olympus | IX71 | |
| 60X objective lens (numerical aperture = 1.35) | Olympus | UPLSAPO 60XO | |
| Excitation filter | Semrock | FF02-472/30 | For voltage imaging of super ecliptic pHluorin in Bongwoori |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Semrock | FF01-497/LP | |
| 75W Xenon arc lamp | CAIRN | OptoSource Illuminator | LEDs and lasers are also effective light sources |
| Slow speed CCD camera | Hitachi | KP-D20BU | |
| Dual port camera adaptor | Olympus | U-DPCAD | |
| High speed CCD camera | RedShirtImaging, LLC | NeuroCCD-SM | |
| Image splitter | CAIRN | Optosplit 2 | |
| Excitation filter | Semrock | FF01-475/23-25 | For voltage imaging of FRET pair based GEVI consisting of Clover and mRuby2) |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Chroma | ET520/40 | |
| Dichroic mirror | Semrock | FF560-FDi01-25X36 | |
| Emission filter | Chroma | ET645/75 | |
| Vibration isolation system | Kinetic systems | 250BM-IC, 5702E-3036-31 | |
| Patching chamber | Warner instruments | RC-26G, 64-0235 | |
| #0 Micro Coverglass (22x40mm) | Electron Microscopy Sciences | 72198-20 | |
| Temperature controller | Warner instruments | TC-344B | |
| #0 (0.08~0.13mm) – 10mm diameter glass coverslip | Ted Pella | 260366 | |
| Lipofection agent | Life Technologies | 11668-027 | |
| Calcium phosphate reagent | Clontech – Takara | 631312 | |
| Patch clamp amplifier | HEKA | EPC 10 USB amplifier | |
| Multi-channel data acquisition software | HEKA | Patchmaster | |
| Image acquisition and analysis software | RedShirtImaging | Neuroplex | |
| Spreadsheet application software | Microsoft | Microsoft Excel 2010 | |
| Data analysis software | OriginLab | OriginPro 8.6.0 | |
| Demagnifier | Qioptiq LINOS | Optem standard camera coupler 0.38x SC38 J clamp | |
| Confocal microscope | Nikon | Nikon A1R confocal microscope | |
| Anti-fade reagent | Life Technologies | P36930 |
References
- Salzberg, B. M., Davila, H. V., Cohen, L. B. Optical recording of impulses in individual neurones of an invertebrate central nervous system. Nature. 246, 508-509 (1973).
- Cohen, L. B., et al. Changes in axon fluorescence during activity: molecular probes of membrane potential. J. Membrane Biol. 19, 1-36 (1974).
- Tasaki, I., Warashina, A. Dye-membrane interaction and its changes during nerve excitation. Photochem Photobiol. 24, 191-207 (1976).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5, 874-885 (2004).
- Jin, L., Han, Z., Platisa, J., Wooltorton, J. R., Cohen, L. B., Pieribone, V. A. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75, 779-785 (2012).
- Cao, G., Platisa, J., Pieribone, V. A., Raccuglia, D., Kunst, M., Nitabach, M. N. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154, 904-913 (2013).
- St-Pierre, F., Marshall, J. D., Yang, Y., Gong, Y., Schnitzer, M. J., Lin, M. Z. High-fidelity optical reporting of neuronal electrical activity with an ultrafast fluorescent voltage sensor. Nat Neurosci. 17, 884-889 (2014).
- Piao, H. H., Rajakumar, D., Kang, B. E., Kim, E. H., Baker, B. J. Combinatorial mutagenesis of the voltage-sensing domain enables the optical resolution of action potentials firing at 60 Hz by a genetically encoded fluorescent sensor of membrane potential. J Neurosci. 35, 372-385 (2015).
- Jung, A., Garcia, J. E., Kim, E., Yoon, B. J., Baker, B. J. Linker length and fusion site composition improve the optical signal of genetically encoded fluorescent voltage sensors. Neurophoton. 2, 021012 (2015).
- Dimitrov, D., et al. Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One. 2, e440 (2007).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9, 1005-1012 (2012).
- Sung, U., et al. Developing fast fluorescent protein voltage sensors by optimizing FRET interactions. PLoS One. 10, e0141585 (2015).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., Maclaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nat Methods. 9, 90-95 (2012).
- Flytzanis, N. C., et al. Archaerhodopsin variants with enhanced voltage-sensitive fluorescence in mammalian and Caenorhabditis elegans neurons. Nat Commun. 5, 4894 (2014).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nat Methods. 11, 825-833 (2014).
- Gong, Y., Wagner, M. J., Zhong Li, J., Schnitzer, M. J. Imaging neural spiking in brain tissue using FRET-opsin protein voltage sensors. Nat Commun. 5, 3674 (2014).
- Zou, P., et al. Bright and fast multicoloured voltage reporters via electrochromic FRET. Nat Commun. 5, 4625 (2014).
- Chanda, B., Blunck, R., Faria, L. C., Schweizer, F. E., Mody, I., Bezanilla, F. A hybrid approach to measuring electrical activity in genetically specified neurons. Nat Neurosci. 8, 1619-1626 (2005).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108, 3147-3160 (2012).
- Weigel, S., Flisikowska, T., Schnieke, A., Luksch, H. Hybrid voltage sensor imaging of eGFP-F expressing neurons in chicken midbrain slices. J Neurosci Methods. 233, 28-33 (2014).
- Waters, J. C., Sluder, G., Wolf, D. E. Live-Cell Fluorescence Imaging. Methods in Cell Biology Volume 81. , 115-140 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nat Protoc. 7, 1741-1754 (2012).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nat Protoc. 1, 695-700 (2006).
- Molleman, A. . Patch clamping: an introductory guide to patch clamp electrophysiology. , 101-102 (2003).
- Osorio, N., Delmas, P. Patch clamp recording from enteric neurons in situ. Nat Protoc. 6, 15-27 (2010).
- Schroder, M., Kaufman, R. J. The mammalian unfolded protein response. Annu Rev Biochem. 74, 739-789 (2005).
- Wilt, B. A., Fitzgerald, J. E., Schnitzer, M. J. Photon shot noise limits on optical detection of neuronal spikes and estimation of spike timing. Biophys J. 104, 51-62 (2013).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knopfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3, e2514 (2008).
- Peterka, D. S., Takahashi, H., Yuste, R. Imaging voltage in neurons. Neuron. 69, 9-21 (2011).

