ממברנה הדמיה פוטנציאלית עם שני סוגי חיישני מתח פלורסנט מקודדים גנטיים
Summary
A method for imaging changes in membrane potential using genetically encoded voltage indicators is described.
Abstract
Genetically encoded voltage indicators (GEVIs) have improved to the point where they are beginning to be useful for in vivo recordings. While the ultimate goal is to image neuronal activity in vivo, one must be able to image activity of a single cell to ensure successful in vivo preparations. This procedure will describe how to image membrane potential in a single cell to provide a foundation to eventually image in vivo. Here we describe methods for imaging GEVIs consisting of a voltage-sensing domain fused to either a single fluorescent protein (FP) or two fluorescent proteins capable of Förster resonance energy transfer (FRET) in vitro. Using an image splitter enables the projection of images created by two different wavelengths onto the same charge-coupled device (CCD) camera simultaneously. The image splitter positions a second filter cube in the light path. This second filter cube consists of a dichroic and two emission filters to separate the donor and acceptor fluorescent wavelengths depending on the FPs of the GEVI. This setup enables the simultaneous recording of both the acceptor and donor fluorescent partners while the membrane potential is manipulated via whole cell patch clamp configuration. When using a GEVI consisting of a single FP, the second filter cube can be removed allowing the mirrors in the image splitter to project a single image onto the CCD camera.
Introduction
המוקד העיקרי של מאמר זה היא להדגים את דימות אופטי של השינויים הפוטנציאלים קרום במבחנה באמצעות חלבוני ניאון מקודדים גנטית. שינויי הדמיה בפוטנציאל הממברנה מציעים את האפשרות המרגשת של לימוד הפעילות של מעגלים עצביים. כאשר שינויי תוצאת פוטנציאל הממברנה לשינוי עוצם קרינה, כל פיקסל של המצלמה הופך אלקטרודה פונדקאית המאפשרים מדידות מפריעה של פעילות עצבית. במשך למעלה מארבעים שנה, צבעי מתח רגישים אורגניים היו מועילים להתבוננות שינויי קרום 1-4 פוטנציאלי. עם זאת, צבעים אלה חסרים סגוליים הסלולר. בנוסף, סוגי תאים מסוימים שקשה להכתים. גנטית אינדיקטורים מתח מקודד (GEVIs) להתגבר על המגבלות האלה ע"י התאים להיחקר במיוחד להביע את החללית מתח רגיש ניאון.
ישנם שלושה סוגים של GEVIs. המחזור הראשון של GEVI משתמש voltage חישת מחשבים מתוך phosphatase חישת המתח גם עם חלבון פלואורסצנטי יחיד (FP) 5-9 או תהודת העברת אנרגית פורסטר (סריג) זוג 10-12. השיעור השני של חיישנים משתמש rhodopsin מיקרוביאלי כאינדיקטור ניאון ישירות 13-15 או באמצעות electrochromic סריג 16,17. המחזור השלישי מנצל שני מרכיבים, המרכיב הגנטי להיות FP מעוגן קרום ומרכיב השני להיות צבע מרווה קרום הנכנס 18-20. בעוד המעמדות השניות והשלישיות שימושיות בניסויים במבחנה פרוס 19,20, רק המחזור הראשון של החיישנים שימושיים כיום עבור in vivo מנתח 6.
בדו"ח זה נדגים את ההדמיה של פוטנציאל הממברנה באמצעות המחלקה הראשונה של GEVIs (איור 1) במבחנה. מחלקה ראשונה זו של חיישנים מתח היא הקלה ביותר לעבור הדמיה in vivo. מאז GEVIs utilizing תחום חישה מתח התמזגו FP הם על פי 50 בהיר יותר מאשר בכיתה rhodopsin של חיישנים, הם יכולים להיות צילמו באמצעות תאורה מנורת קשת ולא לדרוש לייזר בעלת עוצמה אדירה. תוצאה נוספת של הפער הבהיר היא כי המחזור הראשון של GEVIs יכול לחרוג פלואורסצנציה האוטומטית של מוח בקלות. הבדיקות מבוססות rhodopsin לא יכולות. המחזור השלישי של חיישן הוא פשוט בהיר כמו המחלקה ראשונה אבל דורש תוספת של מרווה כימי אשר קשה לנהל in vivo.
אנו, אם כן, להדגים את רכישת בדיקה עם סינגל FP (Bongwoori) 8 ו בדיקה המורכבת זוג סריג (נבי 2) 12. לדאוג בונה בדוח זה הם גרסאות פרפר של VSFP-CR (חלבוני ניאון רגיש מתח – תלתן-mRuby2) 11 המורכב תורם פלואורסצנטי ירוק, תלתן, וכן acceptor ניאון אדום, mRuby2, בשם נבי 2.242 ונבי 2.244 <sעד> 12. במבוא סוגים אלה של הקלטות צריך לתת לחוקרים הבנה טובה יותר של סוג של GEVIs מידע יכול לספק.
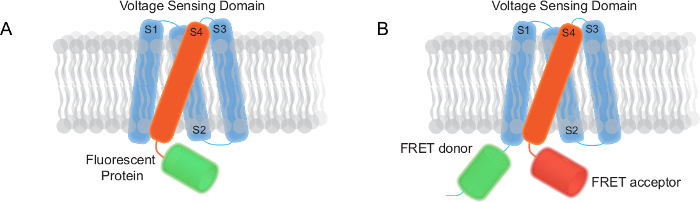
איור 1. שני סוגים של אינדיקטורים מתח מקודדים גנטיים (GEVIs) צלמו הדוח (א) FP מונה מבוסס GEVI שיש תחום חישת מתח קרום טרנס חלבון פלואורסצנטי. (ב) GEVI סריג מבוסס מורכב תחום טרנס-קרום חישת מתח, תורם סריג acceptor. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
מערכת העצבים משתמשת מתח במספר הדרכים שונים, עיכוב גורם hyperpolarization קל, קלט סינפטי גורם שלילת קוטביות קלה וכן תוצאות פוטנציאל פעולה לשינוי מתח גדול יחסית. היכולת למדוד שינויים בפוטנציאל הממברנה על ידי GEVIs מציעה את הפוטנציאל המבטיח של ניתוח מספר מרכיבים של מעגלים עצביים …
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the World Class Institute (WCI) program of the National Research Foundation of Korea funded by Ministry of Education, Science, and Technology of Korea Grant WCI 2009-003 and Korea Institute of Science and Technology Institutional Program Project 2E24210. Sungmoo Lee was supported by Global Ph.D. Fellowship program (NRF-2013H1A2A1033344) of the National Research Foundation (NRF) under the Ministry of Education (MOE, Korea).
Materials
| Inverted Microscope | Olympus | IX71 | |
| 60X objective lens (numerical aperture = 1.35) | Olympus | UPLSAPO 60XO | |
| Excitation filter | Semrock | FF02-472/30 | For voltage imaging of super ecliptic pHluorin in Bongwoori |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Semrock | FF01-497/LP | |
| 75W Xenon arc lamp | CAIRN | OptoSource Illuminator | LEDs and lasers are also effective light sources |
| Slow speed CCD camera | Hitachi | KP-D20BU | |
| Dual port camera adaptor | Olympus | U-DPCAD | |
| High speed CCD camera | RedShirtImaging, LLC | NeuroCCD-SM | |
| Image splitter | CAIRN | Optosplit 2 | |
| Excitation filter | Semrock | FF01-475/23-25 | For voltage imaging of FRET pair based GEVI consisting of Clover and mRuby2) |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Chroma | ET520/40 | |
| Dichroic mirror | Semrock | FF560-FDi01-25X36 | |
| Emission filter | Chroma | ET645/75 | |
| Vibration isolation system | Kinetic systems | 250BM-IC, 5702E-3036-31 | |
| Patching chamber | Warner instruments | RC-26G, 64-0235 | |
| #0 Micro Coverglass (22x40mm) | Electron Microscopy Sciences | 72198-20 | |
| Temperature controller | Warner instruments | TC-344B | |
| #0 (0.08~0.13mm) – 10mm diameter glass coverslip | Ted Pella | 260366 | |
| Lipofection agent | Life Technologies | 11668-027 | |
| Calcium phosphate reagent | Clontech – Takara | 631312 | |
| Patch clamp amplifier | HEKA | EPC 10 USB amplifier | |
| Multi-channel data acquisition software | HEKA | Patchmaster | |
| Image acquisition and analysis software | RedShirtImaging | Neuroplex | |
| Spreadsheet application software | Microsoft | Microsoft Excel 2010 | |
| Data analysis software | OriginLab | OriginPro 8.6.0 | |
| Demagnifier | Qioptiq LINOS | Optem standard camera coupler 0.38x SC38 J clamp | |
| Confocal microscope | Nikon | Nikon A1R confocal microscope | |
| Anti-fade reagent | Life Technologies | P36930 |
References
- Salzberg, B. M., Davila, H. V., Cohen, L. B. Optical recording of impulses in individual neurones of an invertebrate central nervous system. Nature. 246, 508-509 (1973).
- Cohen, L. B., et al. Changes in axon fluorescence during activity: molecular probes of membrane potential. J. Membrane Biol. 19, 1-36 (1974).
- Tasaki, I., Warashina, A. Dye-membrane interaction and its changes during nerve excitation. Photochem Photobiol. 24, 191-207 (1976).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5, 874-885 (2004).
- Jin, L., Han, Z., Platisa, J., Wooltorton, J. R., Cohen, L. B., Pieribone, V. A. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75, 779-785 (2012).
- Cao, G., Platisa, J., Pieribone, V. A., Raccuglia, D., Kunst, M., Nitabach, M. N. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154, 904-913 (2013).
- St-Pierre, F., Marshall, J. D., Yang, Y., Gong, Y., Schnitzer, M. J., Lin, M. Z. High-fidelity optical reporting of neuronal electrical activity with an ultrafast fluorescent voltage sensor. Nat Neurosci. 17, 884-889 (2014).
- Piao, H. H., Rajakumar, D., Kang, B. E., Kim, E. H., Baker, B. J. Combinatorial mutagenesis of the voltage-sensing domain enables the optical resolution of action potentials firing at 60 Hz by a genetically encoded fluorescent sensor of membrane potential. J Neurosci. 35, 372-385 (2015).
- Jung, A., Garcia, J. E., Kim, E., Yoon, B. J., Baker, B. J. Linker length and fusion site composition improve the optical signal of genetically encoded fluorescent voltage sensors. Neurophoton. 2, 021012 (2015).
- Dimitrov, D., et al. Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One. 2, e440 (2007).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9, 1005-1012 (2012).
- Sung, U., et al. Developing fast fluorescent protein voltage sensors by optimizing FRET interactions. PLoS One. 10, e0141585 (2015).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., Maclaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nat Methods. 9, 90-95 (2012).
- Flytzanis, N. C., et al. Archaerhodopsin variants with enhanced voltage-sensitive fluorescence in mammalian and Caenorhabditis elegans neurons. Nat Commun. 5, 4894 (2014).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nat Methods. 11, 825-833 (2014).
- Gong, Y., Wagner, M. J., Zhong Li, J., Schnitzer, M. J. Imaging neural spiking in brain tissue using FRET-opsin protein voltage sensors. Nat Commun. 5, 3674 (2014).
- Zou, P., et al. Bright and fast multicoloured voltage reporters via electrochromic FRET. Nat Commun. 5, 4625 (2014).
- Chanda, B., Blunck, R., Faria, L. C., Schweizer, F. E., Mody, I., Bezanilla, F. A hybrid approach to measuring electrical activity in genetically specified neurons. Nat Neurosci. 8, 1619-1626 (2005).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108, 3147-3160 (2012).
- Weigel, S., Flisikowska, T., Schnieke, A., Luksch, H. Hybrid voltage sensor imaging of eGFP-F expressing neurons in chicken midbrain slices. J Neurosci Methods. 233, 28-33 (2014).
- Waters, J. C., Sluder, G., Wolf, D. E. Live-Cell Fluorescence Imaging. Methods in Cell Biology Volume 81. , 115-140 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nat Protoc. 7, 1741-1754 (2012).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nat Protoc. 1, 695-700 (2006).
- Molleman, A. . Patch clamping: an introductory guide to patch clamp electrophysiology. , 101-102 (2003).
- Osorio, N., Delmas, P. Patch clamp recording from enteric neurons in situ. Nat Protoc. 6, 15-27 (2010).
- Schroder, M., Kaufman, R. J. The mammalian unfolded protein response. Annu Rev Biochem. 74, 739-789 (2005).
- Wilt, B. A., Fitzgerald, J. E., Schnitzer, M. J. Photon shot noise limits on optical detection of neuronal spikes and estimation of spike timing. Biophys J. 104, 51-62 (2013).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knopfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3, e2514 (2008).
- Peterka, D. S., Takahashi, H., Yuste, R. Imaging voltage in neurons. Neuron. 69, 9-21 (2011).

