Membrana de imagem Potencial com dois tipos de sensores de tensão fluorescentes geneticamente codificados
Summary
A method for imaging changes in membrane potential using genetically encoded voltage indicators is described.
Abstract
Genetically encoded voltage indicators (GEVIs) have improved to the point where they are beginning to be useful for in vivo recordings. While the ultimate goal is to image neuronal activity in vivo, one must be able to image activity of a single cell to ensure successful in vivo preparations. This procedure will describe how to image membrane potential in a single cell to provide a foundation to eventually image in vivo. Here we describe methods for imaging GEVIs consisting of a voltage-sensing domain fused to either a single fluorescent protein (FP) or two fluorescent proteins capable of Förster resonance energy transfer (FRET) in vitro. Using an image splitter enables the projection of images created by two different wavelengths onto the same charge-coupled device (CCD) camera simultaneously. The image splitter positions a second filter cube in the light path. This second filter cube consists of a dichroic and two emission filters to separate the donor and acceptor fluorescent wavelengths depending on the FPs of the GEVI. This setup enables the simultaneous recording of both the acceptor and donor fluorescent partners while the membrane potential is manipulated via whole cell patch clamp configuration. When using a GEVI consisting of a single FP, the second filter cube can be removed allowing the mirrors in the image splitter to project a single image onto the CCD camera.
Introduction
O foco principal deste trabalho é demonstrar a imagem óptica de mudanças no potencial de membrana in vitro utilizando proteínas fluorescentes geneticamente codificados. mudanças de imagem no potencial de membrana oferece a excitante possibilidade de estudar a atividade dos circuitos neuronais. Quando as alterações na membrana potencial resultado em uma mudança de intensidade de fluorescência, cada pixel da câmera torna-se um eletrodo substituto permitindo medições não invasivas da atividade neuronal. Por mais de quarenta anos, corantes orgânicos sensíveis à voltagem ter sido útil para observar as alterações no potencial de membrana 1-4. No entanto, estes corantes não possuem especificidade celular. Além disso, alguns tipos de células são difíceis de manchar. indicadores de tensão geneticamente codificados (GEVIs) ultrapassar estas limitações quando as células a ser estudados especificamente expressar a sonda fluorescente sensível à tensão.
Existem três classes de GEVIs. A primeira classe de GEVI usa o voltage de detecção de domínio a partir da fosfatase com sensor de tensão com uma única proteína fluorescente (PF) 5-9 ou um Förster transferência de energia de ressonância (FRET) par 10-12. A segunda classe de sensores utiliza rodopsina microbiana como um indicador fluorescente directamente ou através de FRET 13-15 electrocrómico 16,17. A terceira classe utiliza dois componentes, o componente genético ser um FP membrana ancorada e um segundo componente ser ligada à membrana corante têmpera 18-20. Enquanto as segunda e terceira categorias são úteis para a fatia in vitro e experiências 19,20, apenas a primeira classe de sensores são actualmente úteis para a análise in vivo 6.
Neste relatório, vamos demonstrar a imagem do potencial de membrana usando a primeira classe de GEVIs (Figura 1) in vitro. Esta primeira classe de sensores de tensão é a mais fácil fazer a transição para imagiologia in vivo. Desde GEVIs utilizing um domínio de detecção de tensão fundido com um PF são cerca de 50 vezes mais brilhante do que a classe de rodopsina de sensores, que pode ser trabalhada usando iluminação da lâmpada de arco em vez de exigir um laser extremamente poderosa. Outra consequência da disparidade em brilho é que a primeira classe de GEVIs pode facilmente exceder o auto-fluorescência do cérebro. As sondas à base de rodopsina não pode. A terceira classe de sensores é tão brilhante como a primeira categoria, mas requer a adição de um inibidor químico que é difícil administrar in vivo.
Vamos, portanto, demonstrar a aquisição de uma sonda com uma única FP (Bongwoori) 8 e uma sonda consistindo de um par de FRET (Nabi 2) 12. A FRET constrói neste relatório são versões borboleta de VSFP-CR (proteínas fluorescentes sensíveis à voltagem – Clover-mRuby2) 11 consistindo de um doador fluorescente verde, trevo, e um aceitador fluorescente vermelha, mRuby2, chamado Nabi 2.242 e 2.244 Nabi <s-se> 12. A introdução a estes tipos de gravações deve dar aos pesquisadores uma melhor compreensão do tipo de GEVIs informação pode fornecer.
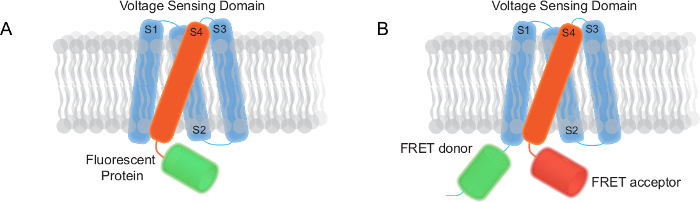
Figura 1. Dois tipos de indicadores geneticamente codificados tensão (GEVIs) Impressas neste relatório (A) A FP mono base GEVI ter um domínio de detecção de tensão trans-membrana e uma proteína fluorescente. (B) A GEVI base FRET composta por um domínio de detecção de tensão trans-membrana, um doador FRET e receptor. Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O sistema nervoso utiliza a tensão de várias maneiras diferentes, a inibição provoca uma ligeira hiperpolarização, entrada sináptica provoca uma ligeira despolarização e uma acção potencial resulta numa mudança relativamente grande tensão. A capacidade de medir as mudanças no potencial da membrana por GEVIs oferece o potencial promissor de analisar vários componentes de circuitos neuronais simultaneamente. Neste relatório nós demonstramos um método fundamental para mudanças de imagem no potencial de m…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the World Class Institute (WCI) program of the National Research Foundation of Korea funded by Ministry of Education, Science, and Technology of Korea Grant WCI 2009-003 and Korea Institute of Science and Technology Institutional Program Project 2E24210. Sungmoo Lee was supported by Global Ph.D. Fellowship program (NRF-2013H1A2A1033344) of the National Research Foundation (NRF) under the Ministry of Education (MOE, Korea).
Materials
| Inverted Microscope | Olympus | IX71 | |
| 60X objective lens (numerical aperture = 1.35) | Olympus | UPLSAPO 60XO | |
| Excitation filter | Semrock | FF02-472/30 | For voltage imaging of super ecliptic pHluorin in Bongwoori |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Semrock | FF01-497/LP | |
| 75W Xenon arc lamp | CAIRN | OptoSource Illuminator | LEDs and lasers are also effective light sources |
| Slow speed CCD camera | Hitachi | KP-D20BU | |
| Dual port camera adaptor | Olympus | U-DPCAD | |
| High speed CCD camera | RedShirtImaging, LLC | NeuroCCD-SM | |
| Image splitter | CAIRN | Optosplit 2 | |
| Excitation filter | Semrock | FF01-475/23-25 | For voltage imaging of FRET pair based GEVI consisting of Clover and mRuby2) |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Chroma | ET520/40 | |
| Dichroic mirror | Semrock | FF560-FDi01-25X36 | |
| Emission filter | Chroma | ET645/75 | |
| Vibration isolation system | Kinetic systems | 250BM-IC, 5702E-3036-31 | |
| Patching chamber | Warner instruments | RC-26G, 64-0235 | |
| #0 Micro Coverglass (22x40mm) | Electron Microscopy Sciences | 72198-20 | |
| Temperature controller | Warner instruments | TC-344B | |
| #0 (0.08~0.13mm) – 10mm diameter glass coverslip | Ted Pella | 260366 | |
| Lipofection agent | Life Technologies | 11668-027 | |
| Calcium phosphate reagent | Clontech – Takara | 631312 | |
| Patch clamp amplifier | HEKA | EPC 10 USB amplifier | |
| Multi-channel data acquisition software | HEKA | Patchmaster | |
| Image acquisition and analysis software | RedShirtImaging | Neuroplex | |
| Spreadsheet application software | Microsoft | Microsoft Excel 2010 | |
| Data analysis software | OriginLab | OriginPro 8.6.0 | |
| Demagnifier | Qioptiq LINOS | Optem standard camera coupler 0.38x SC38 J clamp | |
| Confocal microscope | Nikon | Nikon A1R confocal microscope | |
| Anti-fade reagent | Life Technologies | P36930 |
References
- Salzberg, B. M., Davila, H. V., Cohen, L. B. Optical recording of impulses in individual neurones of an invertebrate central nervous system. Nature. 246, 508-509 (1973).
- Cohen, L. B., et al. Changes in axon fluorescence during activity: molecular probes of membrane potential. J. Membrane Biol. 19, 1-36 (1974).
- Tasaki, I., Warashina, A. Dye-membrane interaction and its changes during nerve excitation. Photochem Photobiol. 24, 191-207 (1976).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5, 874-885 (2004).
- Jin, L., Han, Z., Platisa, J., Wooltorton, J. R., Cohen, L. B., Pieribone, V. A. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75, 779-785 (2012).
- Cao, G., Platisa, J., Pieribone, V. A., Raccuglia, D., Kunst, M., Nitabach, M. N. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154, 904-913 (2013).
- St-Pierre, F., Marshall, J. D., Yang, Y., Gong, Y., Schnitzer, M. J., Lin, M. Z. High-fidelity optical reporting of neuronal electrical activity with an ultrafast fluorescent voltage sensor. Nat Neurosci. 17, 884-889 (2014).
- Piao, H. H., Rajakumar, D., Kang, B. E., Kim, E. H., Baker, B. J. Combinatorial mutagenesis of the voltage-sensing domain enables the optical resolution of action potentials firing at 60 Hz by a genetically encoded fluorescent sensor of membrane potential. J Neurosci. 35, 372-385 (2015).
- Jung, A., Garcia, J. E., Kim, E., Yoon, B. J., Baker, B. J. Linker length and fusion site composition improve the optical signal of genetically encoded fluorescent voltage sensors. Neurophoton. 2, 021012 (2015).
- Dimitrov, D., et al. Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One. 2, e440 (2007).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9, 1005-1012 (2012).
- Sung, U., et al. Developing fast fluorescent protein voltage sensors by optimizing FRET interactions. PLoS One. 10, e0141585 (2015).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., Maclaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nat Methods. 9, 90-95 (2012).
- Flytzanis, N. C., et al. Archaerhodopsin variants with enhanced voltage-sensitive fluorescence in mammalian and Caenorhabditis elegans neurons. Nat Commun. 5, 4894 (2014).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nat Methods. 11, 825-833 (2014).
- Gong, Y., Wagner, M. J., Zhong Li, J., Schnitzer, M. J. Imaging neural spiking in brain tissue using FRET-opsin protein voltage sensors. Nat Commun. 5, 3674 (2014).
- Zou, P., et al. Bright and fast multicoloured voltage reporters via electrochromic FRET. Nat Commun. 5, 4625 (2014).
- Chanda, B., Blunck, R., Faria, L. C., Schweizer, F. E., Mody, I., Bezanilla, F. A hybrid approach to measuring electrical activity in genetically specified neurons. Nat Neurosci. 8, 1619-1626 (2005).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108, 3147-3160 (2012).
- Weigel, S., Flisikowska, T., Schnieke, A., Luksch, H. Hybrid voltage sensor imaging of eGFP-F expressing neurons in chicken midbrain slices. J Neurosci Methods. 233, 28-33 (2014).
- Waters, J. C., Sluder, G., Wolf, D. E. Live-Cell Fluorescence Imaging. Methods in Cell Biology Volume 81. , 115-140 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nat Protoc. 7, 1741-1754 (2012).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nat Protoc. 1, 695-700 (2006).
- Molleman, A. . Patch clamping: an introductory guide to patch clamp electrophysiology. , 101-102 (2003).
- Osorio, N., Delmas, P. Patch clamp recording from enteric neurons in situ. Nat Protoc. 6, 15-27 (2010).
- Schroder, M., Kaufman, R. J. The mammalian unfolded protein response. Annu Rev Biochem. 74, 739-789 (2005).
- Wilt, B. A., Fitzgerald, J. E., Schnitzer, M. J. Photon shot noise limits on optical detection of neuronal spikes and estimation of spike timing. Biophys J. 104, 51-62 (2013).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knopfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3, e2514 (2008).
- Peterka, D. S., Takahashi, H., Yuste, R. Imaging voltage in neurons. Neuron. 69, 9-21 (2011).

