تقييم الابتدائي الانفجار آثار في المختبر
Summary
فهم كيف يتم الخلايا عن طريق التعرض لموجات الصدمة التضمين يمكن أن تساعد في تحديد الآليات وراء الإصابات الناجمة عن أحداث الانفجار. هذا البروتوكول يستخدم معدات أنبوب الصدمة مبنية خصيصا لتطبيق موجات الصدمة في طائفة من الضغوط على مونولاييرس الخلية وتحديد الآثار اللاحقة على بقاء الخلية.
Abstract
يمكن أن يسبب التعرض لإحداث الانفجار صدمة شديدة للأجهزة الحيوية في الجسم مثل الرئتين وأذنيه، والدماغ. فهم الآليات وراء هذه الإصابات الناجمة عن الانفجار أهمية كبرى بالنظر في الاتجاه الأخير نحو استخدام المتفجرات في الحروب الحديثة، والحوادث المتصلة بالإرهاب. لنفهم تماما الضرر الناجم عن الانفجار، يجب أولاً قادرة على تكرار مثل هذه الأحداث الانفجار في بيئة تسيطر عليها باستخدام أسلوب استنساخه. في هذا الأسلوب باستخدام معدات أنبوب الصدمة، يمكن نشر موجات الصدمة في طائفة من الضغوط على الخلايا الحية التي نمت في 2D، ويمكن تحليل البصمات لبقاء الخلية فورا استخدام مقايسة مؤشر الأكسدة والتصوير الفلورسنت من الخلايا الحية والميتة. هذا الأسلوب أثبت أن زيادة يركب انفجار ذروة للجيش الشعبي الكوري 127 يمكن أن تحفز انخفاضا كبيرا في بقاء الخلية عند مقارنتها بعناصر التحكم غير المعالجة. لا تقتصر على خلايا ملتصقة عينات الاختبار، ولكن يمكن أن تشمل تعليق خلية، عينات كامل الجسم والأنسجة، من خلال إجراء تعديلات طفيفة على الإعداد أنبوب الصدمة. من الصعب تكرار الظروف الدقيقة التي تواجه الأنسجة والخلايا عند تعرضها لحادث انفجار حقيقي. يمكن أن تساعد تقنيات مثل تلك المعروضة في هذه المقالة لتحديد عتبات الضرر وتحديد التغييرات النسخي وجينيه داخل الخلايا التي تنشأ من التعرض لموجة الصدمة.
Introduction
مع الاتجاه الأخير نحو استخدام الأجهزة المتفجرة المرتجلة في الحروب الحديثة والأعمال الإرهابية ضد المدنيين، فهم آثار الأحداث المتفجرة في جسم الإنسان ذات أهمية كبيرة. يمكن أن تكون الإصابات التي تم الحصول عليها من خلال التعرض لإحداث انفجار القاتلة والفتاكة، مع العمليات الفيزيائية للإصابة ويجري تقسيمها إلى أربع فئات. نتيجة الإصابات الأولية من التعرض المباشر لموجة الانفجار، الذي يتفاعل مع الجسم محلياً بطريقة ضاغطة وتوسعية في وقت لاحق، مما تسبب في تمزق الأغشية والأنسجة الرخوة1. وتشمل الإصابات الثانوية صدمة حادة أو مخترق الجروح الناجمة عن تأثير مع الأجسام منخفضة الكتلة تدفعها موجه الانفجار في السرعات العالية. تحدث إصابات العالي عند موجه الانفجار لديه طاقة كافية لرمي الأجسام كتلة عالية أو الأفراد ضد الكائنات. وأخيراً، تعرف الإصابات الناجمة عن انفجار رباعي الإصابات الأخرى المتنوعة التي لا تتناسب مع الفئات الأخرى، مثل الحروق فلاش2. وبعد التعرض لمثل هذه الأحداث الانفجار، تشمل الإصابات الأولية الدماغ إصابة3،،من45،6،هيتيروتوبيك التحجر7، انفجار الرئة الإصابة8، فقدان السمع 9، والبعض الآخر10.
هو الموجي الملاحظ عموما من أحداث انفجار موجه فريدلاندر، تمثل انفجار مجاناً-ميدان، مقابل مساحة المغلقة،. ويتكون الموجي جبهة الانفجار التي يمكن تعريفها بأنها ارتفاع حاد وسريع في الضغط الإيجابي. هذا هو متبوعة مباشرة بانفجار رياح من الهواء تتحرك في سرعة عالية وموجه إصدار الذي يقلل من الضغط لأسفل مستويات الغلاف الجوي. يتم ترك فراغ جزئي في منطقة الانفجار الأولى، الذي ينتج في الدفق بطيء للهواء. المراحل الإيجابية والسلبية للموجة (الشكل 1A) تؤدي حركة دفع وجذب انفجار الموجه1. للمساعدة في توضيح الآليات وراء الإصابات الناجمة عن انفجار الأولية، تم إنشاء نماذج تجريبية لإنتاج الطول الموجي، مثل موجه فريدلاندر، التي سوف تواجه الخلايا والأنسجة عند التعرض لحادث انفجار حقيقي. وتشمل النظم الحالية المدرجة في الأدب صدمة أنابيب11،12،13،14،15،،من1617، باروتشامبيرس18،19و بار كولسكي20و المحاكاة المتقدمة انفجار21، شريط ضغط “هوبكنسون تقسيم”22والترفيه لإحداث الانفجار بديلة في بيئة تسيطر عليها باستخدام ثريتول تترانيترات23. على الرغم من مجموعة واسعة من النماذج المتاحة، العديد من المتغيرات تؤثر الإصابة التي تم الحصول عليها من موجات الانفجار، بما في ذلك الضغط قبل تطبيقها، وخصائص الميكانيكية، أنواع الخلايا الفردية أو الأنسجة تحت التقييم24. بينما دراسة أنسجة أو أجهزة يمكن تسليط الضوء على تشوه النسيج وإجمالي التغييرات الشكلية التي تكبدتها نتيجة لإحداث الانفجار، يمكن كشف التحليل على المستوى الخلوي تغييرات جينية والنسخي تتأثر بموجة الصدمة.
توضح هذه المقالة أساليب تقنية لنشر موجات الصدمة في طائفة من الضغوط على الخلايا الحية في أحادي الطبقة. وهذا يسمح لتوصيف الفوري لبقاء الخلية، توضيح عتبات الأضرار المحتملة من موجات الصدمة. وعلاوة على ذلك، يمكن إرجاع خلايا قابلة للتطبيق لشروط الثقافة القياسية، ويمكن تقييم الآثار البيولوجية الطويلة الأجل من حدث الانفجار. البروتوكول أدناه توضح هذه المقالة اثنين من التقنيات بقاء الخلية التي يمكن استخدامها في الخلايا في الثقافة.
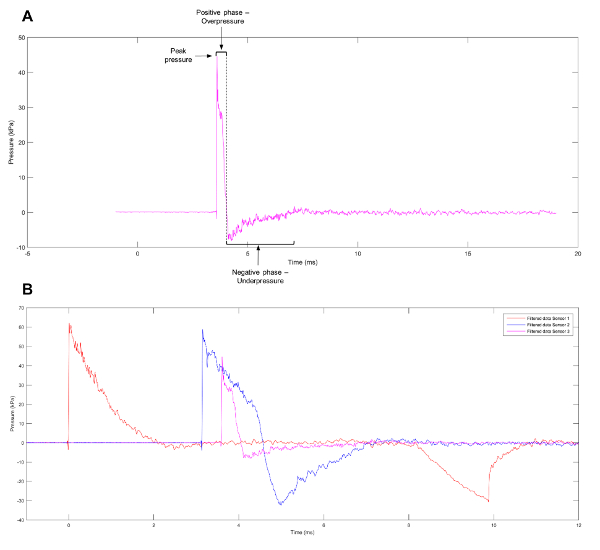
رقم 1: تقدير تقريبي لموجة فريدلاندر. (أ) تقريبي لموجة فريدلاندر لاحظ في استشعار 3 على أنبوب الصدمة. (ب) بيانات تمثيلية تبين الملامح ضغط مختلفة في أجهزة الاستشعار 1 و 2 و 3 على أنبوب الصدمة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
Representative Results
Discussion
الإصابات الأولية التي تم الحصول عليها من التعرض لإحداث الانفجار لا بعد فهم فهما كاملا. تحديد وفهم الآليات التي تؤدي إلى الإصابات الناجمة عن الانفجار، مثل،الدماغ إصابة34 والتحجر هيتيروتوبيك6،7، خطوات أولى هامة لتطوير أساليب فعالة للوقاية. للمساعدة في تحقيق هذا الهدف، وضعت عددا من النظم التجريبية لتكرار انفجار الحدث التعرض11،،من1213،،من1418،19 . الأسلوب الموصوفة هنا يستخدم صدمة أنبوب معدات (الشكل 2) القادرة على إطلاق موجات الصدمة في طائفة من الضغوط في الجسم كله (أي، من القوارض)، والأنسجة، أو عينات الخلايا. القدرة على تحميل أنواع الخلايا الفردية بدلاً من الأنسجة كلها تعطي القدرة على تحليل استجابات خلوية متميزة، كما يمكن أن يحدث تلف في نفس الوقت عن طريق مجموعة من الآليات1،2. على سبيل المثال، نموذج المؤلمة لإصابة في الدماغ، وتقييم أنواع الخلايا الفردية، مثل الخلايا العصبية وأستروسيتيس، يمكن السماح للتعرف على إصابة خلية على حدة. أيضا، يمكن تقييم استجابة الجهاز كلياً باستخدام أنسجة المخ. أنواع الخلايا الفردية وعينات الأنسجة لها قيمة ويمكن أن تعطي معلومات مختلفة. من الممكن أيضا لتغيير كمية الهواء التي يتم الضغط لتوليد الصدمة عن طريق تحديد مدخل مزدوج-المؤخرة أو برنامج تشغيل الأنبوب. وهذا يتحكم في مدة موجه الصدمة. وثمة إمكانية أخرى تغيير الحجاب الحاجز المادي وسمك لتغيير ضغط ذروة25.
هي عامل آخر للنظر في آثار نهاية التدخل التي يمكن أن تكون موجودة عند إسكان عينة يقع بالقرب من خروج أنبوب الصدمة، مثل التي وجدت في تلاعب EVOC المبينة في هذا النظام. شاندرا et al. نظرت إلى ملامح موجه الانفجار وجدت في مواقع مختلفة في أنبوب يحركها ضغط صدمة ووجدت أن الموجي فريدلاندر أفضل ممثلة في مكان عميق داخل أنبوب الصدمة15. كورياكوسي et al. كما درس تحميل الثانوية من العينة ووجد أن وضع صفيحة نهاية في نهاية الأنبوب صدمة كان قادراً على القضاء على الموجات المنعكسة غير المرغوب فيها16. النظر في البيانات الموجودة في هذه المنشورات15،16، يمكن أن تشمل التعديلات المقبلة لتحسين نظام أنبوب الصدمة الموضحة في هذه المقالة موضع تلاعب EVOC في مكان أعمق داخل الأنبوب مدفوعة أو، وبدلاً من ذلك، إدراج صفيحة نهاية على أنبوب الصدمة. ويمكن أن تشمل القيود المفروضة على طريقة وصف الإنتاجية منخفضة نسبيا من العينات. يمكن لمستخدم واحد تعمل أنبوب الصدمة بأمان في ناتج من جميع أنحاء عينات 6-8 للساعة الواحدة. في الوقت الحاضر، تم تصميم النظام حول استخدام أطباق بتري 35 ملم واحد. ولذلك، يمكن أن تكون التجارب الكبيرة التي تحتوي على العديد من المجموعات والبيولوجية replicates صعبة لتحقيق.
يوضح هذا المقال أساليب كيفية تأثر صلاحية خلايا الحليمة جلدي ملتصقة بالتعرض لموجة صدمة واحدة. موجه صدمة قصيرة المدة (< 10 مللي ثانية) من دي سيفن تو الجيش الشعبي الكوري لم يؤثر على إمكانية المقارنة مع عنصر التحكم (رقم 3 و رقم 4). في المقابل، حفزت موجه الصدمة في 127 الجيش الشعبي الكوري انخفاضا كبيرا في البقاء في الانفجار بعد 24 ساعة، كما هو موضح بكل من تحليل مؤشر الأكسدة والاختزال (الشكل 3) وتحليل الصور الفلورية (الشكل 4). ذكر ميلر et al. تخفيض مماثل في بقاء الخلية في الفئران أورجانوتيبيك شريحة هيبوكامبال الثقافات عندما تتعرض الخلايا أما 147 الجيش الشعبي الكوري أو موجه الصدمة 278 الجيش الشعبي الكوري باستخدام أنبوب مفتوح باب العضوية، يحركها الهيليوم صدمة14. وفي المقابل، أفاد فانديفورد et al. أن كان هناك أي تأثير على القدرة على البقاء في astrocytes الفئران المعرضة لَيَرْكَبُ مدة قصيرة من > 200 الجيش الشعبي الكوري، على الرغم من أن باروتشامبير تم استخدامه بدلاً أنبوب صدمة18. تجدر الإشارة إلى أن الضغط الخارجي تعتمد على موجه الانفجار، على الرغم من أن هذا يخلق موجات الإجهاد معقدة داخل الجسم، مما يجعل طبيعة التحميل تعتمد اعتماداً كبيرا على الخواص الميكانيكية للأنسجة أو الخلايا. مطلوب دراسات تحديد خصائص إضافية للاستجابة الخلوية لإحداث الانفجار. وعلاوة على ذلك، بتقييم التعرض موجه صدمة على المستوى الخلوي، كما هو مبين في هذا الأسلوب، الاستجابات البيولوجية الناجمة عن الإصابة، مثل اضطراب من إشارات المسارات أو تغييرات جينية، يمكن تحديدها والمزيد من البحث.
وفي الختام، يصف هذا العمل استخدام أنبوب الفولاذ المقاوم للصدأ صدمة ومنصة EVOC معدلة لدمج الثقافات الخلية الأولية. يمكن إنشاء موجات الصدمة في طائفة من الضغوط ونشرها عبر الخلايا الحية لتكرار التأثيرات التي تحدث من جراء التعرض لموجة انفجار. هذا البروتوكول يوضح كيفية تقييم جدوى الخلية، ولكن يمكن أيضا دراسة التغيرات الأطول أجلاً لأنواع الخلايا الفردية. تسير إلى الأمام، نحن نخطط لتقييم الآثار التفاضلية التي يمكن الحصول على موجات الصدمة المعقدة في أنواع الخلايا المختلفة، بهدف تعزيز فهمنا للإصابات الأولية الناجمة عن الانفجار.
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونود أن نعترف بدعم مالي من “مركز الفيلق الملكي البريطاني” “الدراسات إصابة الانفجار” هكتار والتمويل من “مجلس البحوث الطبية” (M01858X/1) للمعهد.
Materials
| MEM α, nucleosides | ThermoFisher | 22571020 | |
| Fetal Bovine Serum, certified, US origin | ThermoFisher | 16000044 | Supplement to create complete growth media. |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich | D8537 | |
| Penicillin-Streptomycin | ThermoFisher | 15070-063 | Supplement to create complete growth media. |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher | 15400-054 | Dilute 1 in 10 before use. |
| CytoOne T-75 Flask, TC-Treated, vented | Starlab | CC7682-4875 | |
| TC Dish (PS) 35mm, 8.5 cm2 | Triple Red | TCD010035 | |
| Petri dish (PS) 90×14.2mm no vent | VWR UK | 391-0453 | |
| Gas Permeable Adhesive Plate Seals | ThermoFisher | AB-0718 | |
| LIVE/DEAD Cell Imaging Kit (488/570) | ThermoFisher | R37601 | |
| Alamarblue cell viability reagent | Fisher Scientific | 13494309 | |
| Virkon tablets | VWR UK | 115-0020 | Use to create 2% solution as viability control reagent. |
| Dumont forceps | SurgicalTools | 11295-10 | Use to remove coverslips from petri dish. |
| Cover glass, square | VWR UK | 631-0125 | |
| Microscope slides | VWR UK | 631-1553 | |
| 96 Well plate, solid black | AppletonWoods | CC760 | Plate to be used for fluorescence measurements. |
| 96 Well plate, clear, (PS) | VWR UK | 734-1799 | Plate to be used for absorbance measurments. |
| Leica DMi1 Camera stand outfit | Leica Microsystems | Optical microscope used for cell culture. | |
| Zeiss PALM MicroBeam Laser Capture Microdisseciton | Zeiss | Fluorescence microsope used for LIVE/DEAD imaging. | |
| EnVision Multilabel Reader | PerkinElmer | 2104-0010A | Plate reader to be used for fluorescence/absorbance readings. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.023mm | RS Components | 785-0782 | Use to create shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.05mm | RS Components | 785-0786 | Use to creatw shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.125mm | RS Components | 785-0798 | Use to create shock tube diaphragm. |
| Current source power unit | Dytran Intruments Inc. | 4103C | Power source for 2300V1 sensor. |
| IEPE Pressure Sensor | Dytran Intruments Inc. | 2300V1 | Pressure sensor located on shock tube. |
| Digital Phosphor Oscilloscope | Tektronix | DPO 4104B | Use to gather and save sensor 2300V1 data. |
References
- Proud, W. G. The physical basis of explosion and blast injury processes. J R Army Med Corps. 159, 4-9 (2013).
- Born, C. T. Blast Trauma: The Fourth Weapon of Mass Destruction. Scand J of Surg. 94 (4), 279-285 (2005).
- Kocsis, J. D., Tessler, A. Pathology of blast-related brain injury. J Rehabil Res Dev. 46 (6), 667-671 (2009).
- Bass, C. R., et al. Brain Injuries from Blast. Ann Biomed Eng. 40 (1), 185-202 (2012).
- Cernak, I., Kobeissy, F. H. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Alfieri, K. A., Forsberg, J. A., Potter, B. K. Blast injuries and heterotopic ossification. Bone Joint Res. 1 (8), 174-179 (2012).
- Potter, B. K., Burns, T. C., Lacap, A. P., Granville, R. R., Gajewski, D. A. Heterotopic Ossification Following Traumatic and Combat-Related Amputations. Prevalence, Risk Factors, and Preliminary Results of Excision. J Bone Joint Surg Am. 89 (3), 476-486 (2007).
- Sasser, S. M., Sattin, R. W., Hunt, R. C., Krohmer, J. Blast Lung Injury. Prehosp Emerg Care. 10 (2), 165-172 (2006).
- Cho, S. -. I., et al. Mechanisms of Hearing Loss after Blast Injury to the Ear. PLoS ONE. 8 (7), 67618 (2013).
- Bull, M. A., Clasper, J., Mahoney, P. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , (2016).
- Arun, P., et al. Studies on blast traumatic brain injury using in-vitro model with shock tube. Neuroreport. 22 (8), 379-384 (2011).
- Ahlers, S. T., et al. Assessment of the effects of acute and repeated exposure to blast overpressure in rodents: toward a greater understanding of blast and the potential ramifications for injury in humans exposed to blast. Front Neurol. 3, 32 (2012).
- Polfer, E. M., et al. The development of a rat model to investigate the formation of blast-related post-traumatic heterotopic ossification. Bone Joint J. 97 (4), 572-576 (2015).
- Miller, A. P., et al. Effects of Blast Overpressure on Neurons and Glial Cells in Rat Organotypic Hippocampal Slice Cultures. Front Neurol. 6, 20 (2015).
- Chandra, N., et al. Evolution of blast wave profiles in simulated air blasts: experiment and computational modeling. Shock Waves. 22 (5), 403-415 (2012).
- Kuriakose, M., et al. Tailoring the Blast Exposure Conditions in the Shock Tube for Generating Pure, Primary Shock Waves: The End Plate Facilitates Elimination of Secondary Loading of the Specimen. PLoS ONE. 11 (9), 0161597 (2016).
- Reneer, D. V., et al. A Multi-Mode Shock Tube for Investigation of Blast-Induced Traumatic Brain Injury. J Neurotrauma. 28 (1), 95-104 (2011).
- VandeVord, P. J., et al. Up-regulation of reactivity and survival genes in astrocytes after exposure to short duration overpressure. Neurosci Lett. 434 (3), 247-252 (2008).
- Kane, M. J., et al. Altered gene expression in cultured microglia in response to simulated blast overpressure: Possible role of pulse duration. Neurosci Lett. 522 (1), 47-51 (2012).
- Nienaber, M., Lee, J. S., Feng, R., Lim, J. Y. Impulsive pressurization of neuronal cells for traumatic brain injury study. J Vis Exp. (56), (2011).
- Zhang, J., et al. Transcriptional Profiling in Rat Hair Follicles following Simulated Blast Insult: A New Diagnostic Tool for Traumatic Brain Injury. PLoS ONE. 9 (8), 104518 (2014).
- Bo, C., et al. Cellular characterization of compression-induceddamage in live biological samples. AIP Conf Proc. 1426 (1), 153-156 (2012).
- Tannous, O., Griffith, C., O’Toole, R. V., Pellegrini, V. D. Heterotopic ossification after extremity blast amputation in a Sprague-Dawley rat animal model. J Orthop Trauma. 25 (8), 506-510 (2011).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-Vitro Approaches for Studying Blast-Induced Traumatic Brain Injury. J Neurotrauma. 26 (6), 861-876 (2009).
- Nguyen, T. T. N., Wilgeroth, J. M., Proud, W. G. Controlling blast wave generation in a shock tube for biological applications. JPCS. 500 (14), 142025 (2014).

