Valutazione primaria Blast effetti In Vitro
Summary
Comprendere come le cellule sono modulate dall’esposizione a onde d’urto può aiutare a identificare i meccanismi dietro lesioni attivate da eventi di esplosione. Questo protocollo utilizza attrezzature di tubo su misura shock di applicare onde d’urto in una gamma di pressioni di monostrati di cellule umane e di identificare i conseguenti effetti sulla vitalità cellulare.
Abstract
Esposizione a eventi di esplosione può causare gravi traumi agli organi vitali quali i polmoni, le orecchie e nel cervello. La comprensione dei meccanismi dietro tali lesioni di scoppio-indotta è di grande importanza considerando la recente tendenza verso l’uso di esplosivi in modern warfare e incidenti correlati terrorista. Per comprendere appieno la lesione indotta da scoppio, dobbiamo prima essere in grado di replicare tali eventi esplosione in un ambiente controllato utilizzando un metodo riproducibile. In questa tecnica utilizzando attrezzature tubo shock, onde d’urto in una gamma di pressioni può essere propagate su cellule vive coltivate in 2D, e marcatori di attuabilità delle cellule possono essere analizzati immediatamente utilizzando un dosaggio di indicatore redox e l’imaging fluorescente di cellule vivi e morte. Questo metodo ha dimostrato che aumentando la sovrappressione di scoppio di picco a 127 kPa può stimolare un calo significativo nell’attuabilità delle cellule rispetto ai comandi non trattati. Campioni di prova non sono limitati a cellule aderenti, ma possono includere sospensioni cellulari, corpo intero e campioni di tessuto, attraverso piccole modifiche per l’installazione del tubo di scossa. Replicare le esatte condizioni che tessuti e cellule verificano quando esposti ad un evento di vera esplosione è difficile. Tecniche come quello presentato in questo articolo possono aiutare a definire le soglie di danno e identificare i cambiamenti epigenetici e post-trascrizionali all’interno delle cellule che derivano dall’esposizione a onde d’urto.
Introduction
Con la recente tendenza verso l’uso di dispositivi esplosivi improvvisati in modern warfare e azioni terroristiche contro i civili, comprensione degli effetti di eventi esplosivi sul corpo umano è di grande importanza. Lesioni ottenute attraverso l’esposizione a eventi di esplosione possono essere mortale e letale, con i processi fisici della ferita è diviso in quattro categorie. Risultato di lesioni primarie dall’esposizione diretta all’onda d’urto, che interagisce localmente con il corpo in un modo alla compressione e successivamente espansivo, provocando la rottura delle membrane e dei tessuti molli1. Lesioni secondarie includono il trauma smussato o penetrative ferite causate dall’impatto con oggetti di bassa massa azionati ad alta velocità dall’onda d’urto. Terziarie lesioni si verificano quando l’onda d’urto ha energia sufficiente per lanciare oggetti di massa elevata o individui contro oggetti. Infine, lesioni da esplosione quaternario sono definite da altre lesioni varie che non rientrano nelle altre categorie, quali burns flash2. A seguito dell’esposizione ad eventi di scoppio, lesioni primarie includono cerebrali traumatiche lesioni3,4,5, ossificazione heterotopic6,7, esplosione del polmone lesioni8, perdita dell’udito 9e gli altri10.
Una forma d’onda comunemente osservata da eventi di scoppio è l’onda di Friedlander, che rappresenta un campo libero, al contrario di uno spazio racchiuso, esplosione. La forma d’onda è costituito da un fronte di scoppio che può essere definito come un forte e rapido aumento della pressione positiva. Questo è immediatamente seguito da un vento di scoppio di aria in movimento ad alta velocità e un’onda di rilascio che riduce la pressione di sotto livelli atmosferici. Un vuoto parziale è lasciato alla regione dell’esplosione iniziale, che provoca il lento ritorno dell’aria. Le fasi positive e negative dell’onda (Figura 1A) causare il movimento di opposizione del blast wave1. Per contribuire a delucidare i meccanismi dietro lesioni da esplosione primaria, modelli sperimentali sono stati creati per produrre forme d’onda, come l’onda di Friedlander, che cellule e tessuti si troveranno ad affrontare quando esposti all’evento vera esplosione. Gli attuali sistemi elencati nella letteratura includono scossa tubi11,12,13,14,15,16,17, barochambers18,19, la Kolsky bar20, blast avanzati simulatori21, Split Hopkinson pressione bar22e la ricreazione di eventi alternativi esplosione in un ambiente controllato utilizzando Tetranitrato di pentaeritrite23. Nonostante la vasta gamma di modelli disponibili, molte variabili influenzano la ferita ottenuta da onde di esplosione, tra cui lo pre-stress applicato e le proprietà meccaniche del, tipi di singole cellule o tessuti sotto valutazione24. Mentre lo studio di tessuti o organi può gettare luce su deformazione del tessuto ed i cambiamenti morfologici lordi subiti a seguito di eventi di scoppio, analisi al livello cellulare può rivelare i cambiamenti epigenetici e post-trascrizionali, influenzato dall’onda d’urto.
In questo articolo di metodi descrive una tecnica per propagare le onde d’urto in una gamma di pressioni sopra in un monostrato di cellule vive. Questo permette l’immediata caratterizzazione di attuabilità delle cellule, delucidando soglie di danno potenziale da onde d’urto. Inoltre, cellule vitali possono essere restituite a condizioni di coltura standard, e gli effetti biologici a lungo termine dell’evento di esplosione possono essere valutati. Il protocollo qui di seguito vengono descritte due tecniche di attuabilità delle cellule che possono essere utilizzati su cellule in coltura.
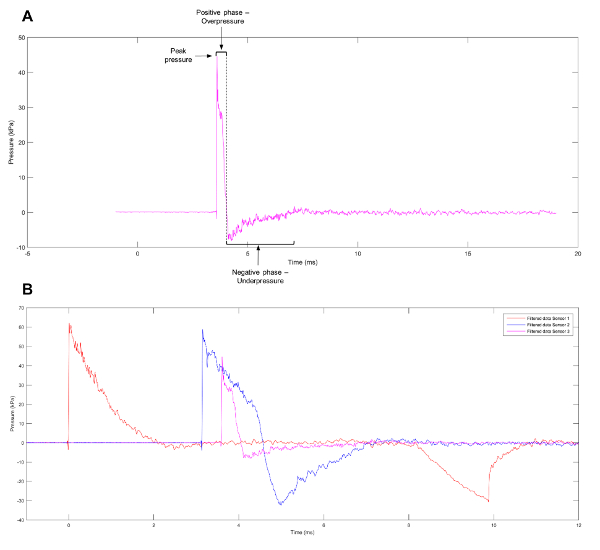
Figura 1: Approssimazione di onda Friedlander. (A) un’approssimazione di un’onda di Friedlander osservata al sensore 3 sul tubo di scossa. (B) dati rappresentativi che mostra i profili di pressione differenti osservati a sensori 1, 2 e 3 del tubo di scossa. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Lesioni primarie ottenute dall’esposizione agli eventi esplosione ancora completamente non sono capite. Identificare e comprendere i meccanismi che si innescano lesioni blast-indotta, come di lesioni cerebrali traumatiche3,4 e ossificazione heterotopic6,7, sono passi importanti per lo sviluppo metodi efficaci di profilassi. Per raggiungere questo obiettivo, un numero di sistemi sperimentali è stato sviluppato per replicare blast evento esposizione11,12,13,14,18,19 . La tecnica descritta qui utilizza attrezzature di tubo di shock (Figura 2) in grado di sparare onde d’urto in una gamma di pressioni al corpo intero (cioè, roditore), tessuto o campioni di cellule. La possibilità di caricare tipi di cellule individuali piuttosto che interi tessuti dà la possibilità di analizzare le risposte cellulari distinte, come danni possono verificarsi contemporaneamente tramite una serie di meccanismi1,2. Ad esempio, per modellare traumatico cranico, la valutazione di singoli tipi di cellule, quali i neuroni ed astrociti, può consentire per l’identificazione di lesioni di cellula-specifico. Inoltre, la risposta di tutto-organo può essere valutata utilizzando il tessuto cerebrale. Entrambi i tipi di cellule individuali e gli esemplari del tessuto hanno valore e possono dare informazioni diverse. È anche possibile modificare la quantità di aria che è pressurizzato per generare lo shock selezionando l’ingresso doppio-culatta o driver-tubo. Questo controlla la durata dell’onda d’urto. Un’altra possibilità consiste nel modificare il materiale della membrana e lo spessore di alterare la pressione di picco25.
Un altro fattore da considerare sono gli effetti di fine di interferenza che possono essere presenti quando l’alloggiamento del campione si trova vicino all’uscita del tubo di scossa, come quello trovato su rig EVOC descritto nel sistema attuale. Corbetta et al. visto anche blast wave profili trovati su posizioni diverse su un tubo di compressione-driven shock e trovato che la forma d’onda di Friedlander meglio è stata rappresentata in una posizione profonda nell’urto tubo15. Kuriakose et al. anche studiato secondaria caricamento del campione e trovato che il posizionamento di una piastra terminale all’estremità del tubo di scossa è stato in grado di eliminare le onde riflesse indesiderate16. Considerando i dati trovati in queste pubblicazioni15,16, future modifiche per migliorare il sistema del tubo di scossa descritto in questo articolo potrebbero coinvolgere il posizionamento dell’impianto di perforazione EVOC in una posizione più profonda all’interno del tubo guidato o, in alternativa, l’inclusione di una piastra di estremità del tubo di scossa. Limitazioni del metodo descritto potrebbero includere la relativamente bassa velocità di trasmissione dei campioni. Un singolo utente può utilizzare il tubo di scossa in piena sicurezza ad una produzione di circa 6-8 campioni / ora. Allo stato attuale, il sistema è stato progettato intorno all’uso singola 35 mm piastre Petri. Pertanto, gli esperimenti più grandi che contengono più gruppi e replicati biologici possono essere difficili da raggiungere.
Questo articolo di metodi viene illustrato come la vitalità delle cellule della papilla dermica aderente è stata influenzata dall’esposizione a una singola onda d’urto. Un’onda di scossa di breve durata (< 10 ms) di ≤72 kPa non ha influenzato la redditività rispetto al controllo (Figura 3 e Figura 4). Al contrario, un’onda d’urto a 127 kPa ha stimolato un calo significativo nell’attuabilità a post-spasso 24h, come mostrato da un saggio di indicatore redox (Figura 3) e l’analisi delle immagini fluorescenti (Figura 4). Miller et al ha segnalato una riduzione simile nell’attuabilità delle cellule nelle colture hippocampal fetta di ratto organotipiche quando le cellule sono state esposte a un uno una 147 kPa o 278 kPa shock wave utilizzando un open-ended, Elio-driven shock tubo14. Al contrario, VandeVord et al ha segnalato che non c’era alcun effetto sulla vitalità negli astrociti di ratto esposti ad una sovrapressione di breve durata di > 200 kPa, anche se una camera di decompressione è stato usato piuttosto che una scossa tubo18. Dovrebbe essere notato che la pressione esterna si affida all’onda d’urto, anche se questo crea onde stress complesso all’interno del corpo, rendendo quindi la natura del carico altamente dipendono le proprietà meccaniche dei tessuti o delle cellule. Studi di ulteriore caratterizzazione della risposta cellulare agli eventi di esplosione è necessaria. Inoltre, di valutare l’esposizione di onda d’urto a livello cellulare, come mostrato in questa tecnica, risposte biologiche innescate dal pregiudizio, come ad esempio la perturbazione della segnalazione vie o i cambiamenti epigenetici, possono essere identificate e ulteriormente esplorate.
In conclusione, questo lavoro viene descritto l’utilizzo di un tubo di acciaio inox scossa e un rig EVOC modificato per incorporare colture cellulari primarie. Onde d’urto in una gamma di pressioni può essere generate e propagate su cellule vive per replicare gli effetti che si verificano da esposizione a un’onda d’urto. Questo protocollo viene illustrato come valutare la vitalità cellulare, ma anche possono essere studiate più a lungo termine modifiche ai tipi di cella singola. Andando avanti, ci proponiamo di valutare gli effetti differenziali che complesse onde d’urto può suscitare in diversi tipi cellulari, con l’obiettivo di favorire la nostra comprensione delle lesioni primarie blast-indotta.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vorremmo riconoscere il sostegno finanziario del Royal British Legion centro per gli studi di lesione Blast HA e finanziamenti dal Medical Research Council (M01858X/1) di CAH.
Materials
| MEM α, nucleosides | ThermoFisher | 22571020 | |
| Fetal Bovine Serum, certified, US origin | ThermoFisher | 16000044 | Supplement to create complete growth media. |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich | D8537 | |
| Penicillin-Streptomycin | ThermoFisher | 15070-063 | Supplement to create complete growth media. |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher | 15400-054 | Dilute 1 in 10 before use. |
| CytoOne T-75 Flask, TC-Treated, vented | Starlab | CC7682-4875 | |
| TC Dish (PS) 35mm, 8.5 cm2 | Triple Red | TCD010035 | |
| Petri dish (PS) 90×14.2mm no vent | VWR UK | 391-0453 | |
| Gas Permeable Adhesive Plate Seals | ThermoFisher | AB-0718 | |
| LIVE/DEAD Cell Imaging Kit (488/570) | ThermoFisher | R37601 | |
| Alamarblue cell viability reagent | Fisher Scientific | 13494309 | |
| Virkon tablets | VWR UK | 115-0020 | Use to create 2% solution as viability control reagent. |
| Dumont forceps | SurgicalTools | 11295-10 | Use to remove coverslips from petri dish. |
| Cover glass, square | VWR UK | 631-0125 | |
| Microscope slides | VWR UK | 631-1553 | |
| 96 Well plate, solid black | AppletonWoods | CC760 | Plate to be used for fluorescence measurements. |
| 96 Well plate, clear, (PS) | VWR UK | 734-1799 | Plate to be used for absorbance measurments. |
| Leica DMi1 Camera stand outfit | Leica Microsystems | Optical microscope used for cell culture. | |
| Zeiss PALM MicroBeam Laser Capture Microdisseciton | Zeiss | Fluorescence microsope used for LIVE/DEAD imaging. | |
| EnVision Multilabel Reader | PerkinElmer | 2104-0010A | Plate reader to be used for fluorescence/absorbance readings. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.023mm | RS Components | 785-0782 | Use to create shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.05mm | RS Components | 785-0786 | Use to creatw shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.125mm | RS Components | 785-0798 | Use to create shock tube diaphragm. |
| Current source power unit | Dytran Intruments Inc. | 4103C | Power source for 2300V1 sensor. |
| IEPE Pressure Sensor | Dytran Intruments Inc. | 2300V1 | Pressure sensor located on shock tube. |
| Digital Phosphor Oscilloscope | Tektronix | DPO 4104B | Use to gather and save sensor 2300V1 data. |
References
- Proud, W. G. The physical basis of explosion and blast injury processes. J R Army Med Corps. 159, 4-9 (2013).
- Born, C. T. Blast Trauma: The Fourth Weapon of Mass Destruction. Scand J of Surg. 94 (4), 279-285 (2005).
- Kocsis, J. D., Tessler, A. Pathology of blast-related brain injury. J Rehabil Res Dev. 46 (6), 667-671 (2009).
- Bass, C. R., et al. Brain Injuries from Blast. Ann Biomed Eng. 40 (1), 185-202 (2012).
- Cernak, I., Kobeissy, F. H. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Alfieri, K. A., Forsberg, J. A., Potter, B. K. Blast injuries and heterotopic ossification. Bone Joint Res. 1 (8), 174-179 (2012).
- Potter, B. K., Burns, T. C., Lacap, A. P., Granville, R. R., Gajewski, D. A. Heterotopic Ossification Following Traumatic and Combat-Related Amputations. Prevalence, Risk Factors, and Preliminary Results of Excision. J Bone Joint Surg Am. 89 (3), 476-486 (2007).
- Sasser, S. M., Sattin, R. W., Hunt, R. C., Krohmer, J. Blast Lung Injury. Prehosp Emerg Care. 10 (2), 165-172 (2006).
- Cho, S. -. I., et al. Mechanisms of Hearing Loss after Blast Injury to the Ear. PLoS ONE. 8 (7), 67618 (2013).
- Bull, M. A., Clasper, J., Mahoney, P. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , (2016).
- Arun, P., et al. Studies on blast traumatic brain injury using in-vitro model with shock tube. Neuroreport. 22 (8), 379-384 (2011).
- Ahlers, S. T., et al. Assessment of the effects of acute and repeated exposure to blast overpressure in rodents: toward a greater understanding of blast and the potential ramifications for injury in humans exposed to blast. Front Neurol. 3, 32 (2012).
- Polfer, E. M., et al. The development of a rat model to investigate the formation of blast-related post-traumatic heterotopic ossification. Bone Joint J. 97 (4), 572-576 (2015).
- Miller, A. P., et al. Effects of Blast Overpressure on Neurons and Glial Cells in Rat Organotypic Hippocampal Slice Cultures. Front Neurol. 6, 20 (2015).
- Chandra, N., et al. Evolution of blast wave profiles in simulated air blasts: experiment and computational modeling. Shock Waves. 22 (5), 403-415 (2012).
- Kuriakose, M., et al. Tailoring the Blast Exposure Conditions in the Shock Tube for Generating Pure, Primary Shock Waves: The End Plate Facilitates Elimination of Secondary Loading of the Specimen. PLoS ONE. 11 (9), 0161597 (2016).
- Reneer, D. V., et al. A Multi-Mode Shock Tube for Investigation of Blast-Induced Traumatic Brain Injury. J Neurotrauma. 28 (1), 95-104 (2011).
- VandeVord, P. J., et al. Up-regulation of reactivity and survival genes in astrocytes after exposure to short duration overpressure. Neurosci Lett. 434 (3), 247-252 (2008).
- Kane, M. J., et al. Altered gene expression in cultured microglia in response to simulated blast overpressure: Possible role of pulse duration. Neurosci Lett. 522 (1), 47-51 (2012).
- Nienaber, M., Lee, J. S., Feng, R., Lim, J. Y. Impulsive pressurization of neuronal cells for traumatic brain injury study. J Vis Exp. (56), (2011).
- Zhang, J., et al. Transcriptional Profiling in Rat Hair Follicles following Simulated Blast Insult: A New Diagnostic Tool for Traumatic Brain Injury. PLoS ONE. 9 (8), 104518 (2014).
- Bo, C., et al. Cellular characterization of compression-induceddamage in live biological samples. AIP Conf Proc. 1426 (1), 153-156 (2012).
- Tannous, O., Griffith, C., O’Toole, R. V., Pellegrini, V. D. Heterotopic ossification after extremity blast amputation in a Sprague-Dawley rat animal model. J Orthop Trauma. 25 (8), 506-510 (2011).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-Vitro Approaches for Studying Blast-Induced Traumatic Brain Injury. J Neurotrauma. 26 (6), 861-876 (2009).
- Nguyen, T. T. N., Wilgeroth, J. M., Proud, W. G. Controlling blast wave generation in a shock tube for biological applications. JPCS. 500 (14), 142025 (2014).

