評価プライマリ ブラスト効果の in Vitro
Summary
衝撃波への露出によって細胞を変調する方法を理解することは爆発イベントからトリガーの傷害の背後にあるメカニズムを識別するを助けることができます。このプロトコルは、細胞膜に圧力の範囲で衝撃波を適用して細胞生存率のそれ以降の効果を識別するために、特注の衝撃波管装置を使用します。
Abstract
爆発イベントへの露出は肺、耳や脳など重要な臓器に重篤な外傷を引き起こす可能性が。現代の戦争とテロ関連の事件の爆発物の使用への最近の動向を考慮した非常に重要なはそのような爆発による傷害の背後にあるメカニズムを理解すること。爆発による傷害を完全に理解するに、制御された環境で再現可能な方法を使用してこのような爆発イベントを複製することはまずなりません。この手法は衝撃管装置を使用して、衝撃波圧力の範囲内では、2 D で成長して生きた細胞を伝播できるし、細胞のマーカーは酸化還元インジケーター試金とライブとデッド細胞の蛍光イメージングを使用してすぐに分析できます。このメソッドは、127 kpa ピーク爆発圧力の増加、大幅な低下がセル実行可能性未処理のコントロールと比較して刺激することを示した。テスト サンプルは付着性の細胞に限定されないが、細胞懸濁液を含めることができますショック チューブ セットアップするマイナーな修正によって、全身と組織のサンプル。組織や細胞が発生する本物の爆発イベントに露出されたとき厳密な条件を複製することは困難です。この記事で示す 1 つなどのテクニックは、損傷しきい値を定義し、衝撃波の暴露から生じる細胞内転写およびエピジェネティックな変化を識別に役立ちます。
Introduction
モダンウォー フェアと民間人に対するテロ行為の即席に作られた爆発物の使用傾向の最近、大きい重要性の爆発的なイベントの人体に及ぼす影響を理解することです。爆発イベントへの暴露を介して得られる傷害が致命的な 4 つのカテゴリに分割されている損傷の物理的なプロセスと、致命的なことができます。膜及び軟部組織1の混乱を引き起こし、圧縮でその後広範な方法でボディとローカル相互作用する爆風への直接暴露から主要な傷害の結果。二次傷害は、外傷または浸透の傷による影響、爆風によって高速で推進する低質量オブジェクトに含まれます。第三紀の負傷は、爆風波に高い質量またはオブジェクトに対して個人のオブジェクトをスローするように十分なエネルギーがある場合に発生します。最後に、第四紀の爆風損傷はフラッシュやけど2など、他のカテゴリに適合しないその他の他傷害によって定義されます。次の爆発のようなイベントへの暴露, 主傷害は、外傷性脳傷害3,4、5、異所性骨化6、7ブラスト肺傷害8聴覚の損失9、その他10。
爆発イベントから一般的観測波形は、自由音場、閉鎖空間ではなく爆発を表すフリードランダー波です。波形は、肯定的な圧力で急激かつ急速な上昇として定義することができます爆発前で構成されています。これは高速で大気中濃度以下に圧力を減らすリリース波移動空気の爆風によって直後に。部分的な真空空気の遅い逆流の結果初期の爆発のままです。ブラスト波1のプッシュ ・ プルの動き波 (図 1 a) の正および負のフェーズがあります。プライマリ爆風損傷の背後にあるメカニズムを解明するには、細胞や組織に直面するだろう本物の爆発イベントに露出されたときフリードランダー波などの波形を生成する実験モデルを作成されています。文献に記載されている現在のシステムは、ショック チューブ11,12,13,14,15,16,17、します。制御された環境で代替爆発イベントのレクリエーション、ホプキンソン圧力バー22高度なブラスト シミュレータ21Kolsky バー20barochambers18,1923はテトラ硝酸塩ペンタのエリスリトール。利用可能なモデルの広い範囲にかかわらず多くの変数を適用する前のストレスを含む爆発波および個々 のセル型または評価24の下の組織の機械的性質から得られる傷害に影響を与えます。一方、組織または臓器の研究組織の変形と爆発イベントの結果として持続的な総体の形態学的変化に光を当てることができます、細胞レベルでの解析は衝撃波によって影響を受け転写およびエピジェネティックな変化を検出できます。
この方法の記事では、衝撃波圧力の範囲内で生きている細胞単層を伝達する手法について説明します。衝撃波からの潜在的な損傷しきい値を解明、細胞生存率の即時の特性評価が可能になります。さらに、標準的な培養条件に実行可能なセルを返すことができる、爆発イベントから長期的生物学的影響を評価することができます。以下のプロトコルでは、培養細胞に使用することができます 2 つの細胞の生存率の技術について説明します。
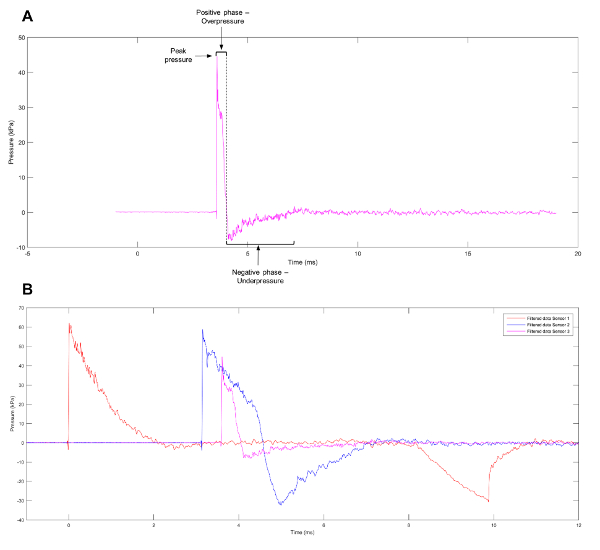
図 1:フリードランダー波の近似します。(A) 無隔膜ショック ・ チューブの 3 センサーで観測されたフリードランダー波の近似。(B) 代表的なデータの衝撃波管の 3、2、1 のセンサーで観測された異なる圧力プロファイルを表示します。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
爆発イベントへの暴露から得られた主要な傷害はまだ完全に理解されません。識別し、外傷性脳傷害3,などの爆発による傷害を発生させるメカニズムを理解すること4異所性骨化6、7の開発に重要な最初のステップであります。予防の効果的な方法です。この目標を達成するためには、爆発イベント露出11,12,13,14,18,19 をレプリケートする実験システムの数が開発されて.説明する手法は、ここで全身 (すなわち、齧歯動物)、組織、または細胞のサンプルでの圧力の範囲で衝撃波を発射可能な衝撃管装置 (図 2) を使用します。組織全体ではなく個々 のセル型をロードする機能は、損傷がメカニズム1,2の範囲で同時に発生することが明確な細胞応答を解析する能力。たとえば、外傷性をモデル化する脳損傷、神経細胞やアストロ サイトなどの個々 のセル型の評価をセル固有の損傷の同定に許可できます。また、全臓器応答は、脳組織を使用して評価できます。個々 のセルの種類と組織標本値を有し、さまざまな情報を与えることができます。また、ダブル砲尾またはドライバー管の入口を選択することにより衝撃を生成する加圧空気の量を変更することが可能です。これは衝撃波の持続期間を制御します。別の可能性は、ダイアフラム材質と厚さ25ピーク圧力を変更するを変更することです。
考慮する別の要因は、サンプル住宅は本システムに記載されている EVOC リグにあるなど、無隔膜ショック ・ チューブの出口近くに位置するときに存在することができます干渉終了効果です。チャンドラらブラスト波プロファイル圧縮駆動衝撃波管のさまざまな場所で発見し、発見フリードランダー波形が深い衝撃管15内の場所で表された最高を見た。Kuriakoseらまた、サンプルのセカンダリの読み込みを学び、衝撃波管の終わりにエンド プレートの配置は16不要な反射波を除去することができることがわかった。この資料に記載されているショック チューブ システムを改善する将来的な変更は駆動チューブ内のより深い位置に EVOC リグの配置を含むことができるこれら出版物15,16で見つかったデータを考慮したり、また、無隔膜ショック ・ チューブのエンド プレートを含めること。この方法の制限は、サンプルのスループットが比較的低くてを含めることができます。単一のユーザーは周りの出力で安全に衝撃波管を操作できる時間あたりのサンプル数 6-8。現時点では、システムは単一の 35 mm シャーレの使用を回避設計されています。したがって、複数のグループと生物の複製を含むより大きい実験は達成することは困難することができます。
このメソッド記事付着毛乳頭細胞の生存率が単一衝撃波への露出によってどのように影響を受けるかを示しています。短時間の衝撃波 (< 10 ms) コントロール (図 3および図 4) と比較した場合の生存率が ≤72 の kPa に影響しなかった。酸化還元インジケーター試金 (図 3) と蛍光画像解析 (図 4) の両方で示すように、対照的に、127 kPa で衝撃波は、24 h 後爆発で生存率で大幅な低下を刺激します。細胞は、いずれかにさらされたとき、ミラーらがラット脊髄海馬スライス培養における細胞生存率の同様なリスク減少を報告 147 kPa またはオープン エンド、ヘリウム駆動ショック チューブ14を使用して 278 kPa 衝撃波。対照的に、VandeVordらは報告の短時間の超過圧力にさらされたラット アストロ サイトにおける生存力に効果がなかった > 200 kPa、ショック チューブ18ではなく、barochamber が使用されました。しますがそのため、荷重の性質をティッシュか細胞の機械的特性に大きく依存して、本体内で複雑な応力波、外部圧力が爆風波に依存していることに注意してください。爆発イベントに対する細胞応答のさらに特性評価研究が必要です。さらに、この手法で示すように、細胞レベルでの衝撃波を評価する、ことによって生物学的応答シグナル伝達経路やエピジェネティックな変化の摂動などの損傷からトリガーを識別してさらに検討します。
結論としては、この作品は、ステンレス鋼衝撃波管と一次電池文化を組み込む変更された EVOC リグの使用について説明します。衝撃波圧力の範囲内では、生成され、爆風波への暴露から発生する効果を複製する生きているセルを介して伝達することができます。このプロトコルは細胞の生存率を評価する方法を示しますが、個々 のセルの種類を長期的な変化を検討もできます。今後からは、我々 は複雑な衝撃波は爆発による主な傷害の私達の理解を促進することを目的と異なったセルタイプで引き出すことができる差動効果を評価する予定です。
Disclosures
The authors have nothing to disclose.
Acknowledgements
HA と CAH に医学研究評議会 (M01858X/1) から資金調達する爆風損傷研究のロイヤル英国リージョン センターの助成を受けたいと思います。
Materials
| MEM α, nucleosides | ThermoFisher | 22571020 | |
| Fetal Bovine Serum, certified, US origin | ThermoFisher | 16000044 | Supplement to create complete growth media. |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich | D8537 | |
| Penicillin-Streptomycin | ThermoFisher | 15070-063 | Supplement to create complete growth media. |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher | 15400-054 | Dilute 1 in 10 before use. |
| CytoOne T-75 Flask, TC-Treated, vented | Starlab | CC7682-4875 | |
| TC Dish (PS) 35mm, 8.5 cm2 | Triple Red | TCD010035 | |
| Petri dish (PS) 90×14.2mm no vent | VWR UK | 391-0453 | |
| Gas Permeable Adhesive Plate Seals | ThermoFisher | AB-0718 | |
| LIVE/DEAD Cell Imaging Kit (488/570) | ThermoFisher | R37601 | |
| Alamarblue cell viability reagent | Fisher Scientific | 13494309 | |
| Virkon tablets | VWR UK | 115-0020 | Use to create 2% solution as viability control reagent. |
| Dumont forceps | SurgicalTools | 11295-10 | Use to remove coverslips from petri dish. |
| Cover glass, square | VWR UK | 631-0125 | |
| Microscope slides | VWR UK | 631-1553 | |
| 96 Well plate, solid black | AppletonWoods | CC760 | Plate to be used for fluorescence measurements. |
| 96 Well plate, clear, (PS) | VWR UK | 734-1799 | Plate to be used for absorbance measurments. |
| Leica DMi1 Camera stand outfit | Leica Microsystems | Optical microscope used for cell culture. | |
| Zeiss PALM MicroBeam Laser Capture Microdisseciton | Zeiss | Fluorescence microsope used for LIVE/DEAD imaging. | |
| EnVision Multilabel Reader | PerkinElmer | 2104-0010A | Plate reader to be used for fluorescence/absorbance readings. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.023mm | RS Components | 785-0782 | Use to create shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.05mm | RS Components | 785-0786 | Use to creatw shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.125mm | RS Components | 785-0798 | Use to create shock tube diaphragm. |
| Current source power unit | Dytran Intruments Inc. | 4103C | Power source for 2300V1 sensor. |
| IEPE Pressure Sensor | Dytran Intruments Inc. | 2300V1 | Pressure sensor located on shock tube. |
| Digital Phosphor Oscilloscope | Tektronix | DPO 4104B | Use to gather and save sensor 2300V1 data. |
References
- Proud, W. G. The physical basis of explosion and blast injury processes. J R Army Med Corps. 159, 4-9 (2013).
- Born, C. T. Blast Trauma: The Fourth Weapon of Mass Destruction. Scand J of Surg. 94 (4), 279-285 (2005).
- Kocsis, J. D., Tessler, A. Pathology of blast-related brain injury. J Rehabil Res Dev. 46 (6), 667-671 (2009).
- Bass, C. R., et al. Brain Injuries from Blast. Ann Biomed Eng. 40 (1), 185-202 (2012).
- Cernak, I., Kobeissy, F. H. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Alfieri, K. A., Forsberg, J. A., Potter, B. K. Blast injuries and heterotopic ossification. Bone Joint Res. 1 (8), 174-179 (2012).
- Potter, B. K., Burns, T. C., Lacap, A. P., Granville, R. R., Gajewski, D. A. Heterotopic Ossification Following Traumatic and Combat-Related Amputations. Prevalence, Risk Factors, and Preliminary Results of Excision. J Bone Joint Surg Am. 89 (3), 476-486 (2007).
- Sasser, S. M., Sattin, R. W., Hunt, R. C., Krohmer, J. Blast Lung Injury. Prehosp Emerg Care. 10 (2), 165-172 (2006).
- Cho, S. -. I., et al. Mechanisms of Hearing Loss after Blast Injury to the Ear. PLoS ONE. 8 (7), 67618 (2013).
- Bull, M. A., Clasper, J., Mahoney, P. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , (2016).
- Arun, P., et al. Studies on blast traumatic brain injury using in-vitro model with shock tube. Neuroreport. 22 (8), 379-384 (2011).
- Ahlers, S. T., et al. Assessment of the effects of acute and repeated exposure to blast overpressure in rodents: toward a greater understanding of blast and the potential ramifications for injury in humans exposed to blast. Front Neurol. 3, 32 (2012).
- Polfer, E. M., et al. The development of a rat model to investigate the formation of blast-related post-traumatic heterotopic ossification. Bone Joint J. 97 (4), 572-576 (2015).
- Miller, A. P., et al. Effects of Blast Overpressure on Neurons and Glial Cells in Rat Organotypic Hippocampal Slice Cultures. Front Neurol. 6, 20 (2015).
- Chandra, N., et al. Evolution of blast wave profiles in simulated air blasts: experiment and computational modeling. Shock Waves. 22 (5), 403-415 (2012).
- Kuriakose, M., et al. Tailoring the Blast Exposure Conditions in the Shock Tube for Generating Pure, Primary Shock Waves: The End Plate Facilitates Elimination of Secondary Loading of the Specimen. PLoS ONE. 11 (9), 0161597 (2016).
- Reneer, D. V., et al. A Multi-Mode Shock Tube for Investigation of Blast-Induced Traumatic Brain Injury. J Neurotrauma. 28 (1), 95-104 (2011).
- VandeVord, P. J., et al. Up-regulation of reactivity and survival genes in astrocytes after exposure to short duration overpressure. Neurosci Lett. 434 (3), 247-252 (2008).
- Kane, M. J., et al. Altered gene expression in cultured microglia in response to simulated blast overpressure: Possible role of pulse duration. Neurosci Lett. 522 (1), 47-51 (2012).
- Nienaber, M., Lee, J. S., Feng, R., Lim, J. Y. Impulsive pressurization of neuronal cells for traumatic brain injury study. J Vis Exp. (56), (2011).
- Zhang, J., et al. Transcriptional Profiling in Rat Hair Follicles following Simulated Blast Insult: A New Diagnostic Tool for Traumatic Brain Injury. PLoS ONE. 9 (8), 104518 (2014).
- Bo, C., et al. Cellular characterization of compression-induceddamage in live biological samples. AIP Conf Proc. 1426 (1), 153-156 (2012).
- Tannous, O., Griffith, C., O’Toole, R. V., Pellegrini, V. D. Heterotopic ossification after extremity blast amputation in a Sprague-Dawley rat animal model. J Orthop Trauma. 25 (8), 506-510 (2011).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-Vitro Approaches for Studying Blast-Induced Traumatic Brain Injury. J Neurotrauma. 26 (6), 861-876 (2009).
- Nguyen, T. T. N., Wilgeroth, J. M., Proud, W. G. Controlling blast wave generation in a shock tube for biological applications. JPCS. 500 (14), 142025 (2014).

