Évaluation primaire Blast effets In Vitro
Summary
Comprendre comment les cellules sont modulés par l’exposition aux ondes de choc peut aider à identifier les mécanismes derrière les blessures déclenchés des événements de l’explosion. Ce protocole utilise le matériel de tube de choc sur mesure pour appliquer des ondes de choc à une gamme de pressions aux monocouches de cellules et d’identifier les effets ultérieurs sur la viabilité des cellules.
Abstract
Exposition aux événements de souffle peut causer un traumatisme grave des organes vitaux comme les poumons, les oreilles et cerveau. Compréhension des mécanismes à l’origine de ces blessures induite par l’explosion est d’une grande importance compte tenu de la tendance récente à l’utilisation d’explosifs dans modern warfare et incidents liés à des activités terroristes. Pour comprendre pleinement les dommages causés par l’explosion, nous devons tout d’abord être capables de se répliquer ces événements souffle dans un environnement contrôlé à l’aide d’une méthode reproductible. Dans cette technique à l’aide de matériel de tube de choc, ondes de choc à une gamme de pressions peuvent être propagées sur des cellules vivantes, cultivés en 2D et marqueurs de viabilité cellulaire peuvent être immédiatement analysés à l’aide d’un test d’indicateur rédox et l’imagerie de fluorescence des cellules vivantes et mortes. Cette méthode a démontré qu’augmentant la surpression d’explosion pic à 127 kPa peut favoriser une baisse significative dans la viabilité des cellules par rapport aux témoins non traités. Échantillons d’essai ne se limitent pas aux cellules adhérentes, mais peut inclure des suspensions cellulaires, échantillons dans tout l’organisme et les tissus, grâce à légères modifications à la configuration de tube de choc. Il est difficile de reproduire les conditions exactes que les tissus et cellules d’expérience lorsqu’il est exposé à un événement de véritable explosion. Des techniques telles que celle présentée dans cet article peuvent aider à définir des seuils de nuisibilité et identifier les changements transcriptionnelles et épigénétiques dans les cellules qui se posent à l’exposition de l’onde de choc.
Introduction
Avec la récente tendance à l’utilisation d’engins explosifs improvisés dans modern warfare et des actions terroristes contre des civils, comprendre les effets des événements explosifs sur le corps humain est d’une grande importance. Blessures obtenues par exposition aux événements de souffle peuvent être mortelle et mortelle, avec les processus physiques de blessures étant divisés en quatre catégories. Primaire se traduisant d’une exposition directe à l’onde de choc, qui interagit localement avec le corps d’une manière compression et par la suite expansive, provoquant la rupture des membranes et des tissus mous1. Lésions secondaires incluent un traumatisme contondant ou pénétration blessures causés par l’impact avec des objets de faible masse propulsés à grande vitesse de l’onde de choc. Tertiaires blessures se produisent lorsque l’onde de choc suffisamment d’énergie pour jeter des objets de masse élevée ou des individus contre les objets. Enfin, les blessures blast quaternaire sont définies par autres blessures diverses qui ne rentrent pas les autres catégories, telles que des brûlures flash2. Après une exposition à de tels événements blast, dommages primaires incluent traumatisme cérébral lésion3,4,5, ossification hétérotopique6,7, blast pulmonaire blessure8, perte d’audition 9et autres10.
Une forme d’onde couramment observé d’événements blast est la vague de Friedlander, représentant une explosion de champ libre, par opposition à un espace clos. L’onde se compose d’un front d’explosion qui peut être défini comme une augmentation rapide et forte pression positive. Elle est immédiatement suivie d’un vent du souffle de l’air se déplaçant à grande vitesse et une vague de libération qui réduit la pression au-dessous des niveaux atmosphériques. Un vide partiel est laissé à la région de l’explosion initiale, qui se traduit par le lent reflux d’air. Les phases positives et négatives de l’onde (Figure 1 a) entraîner le mouvement de va-et-vient du souffle vague1. Pour aider à élucider les mécanismes derrière les blessures de l’explosion primaire, modèles expérimentaux ont été créés pour produire des formes d’onde, tels que la vague de Friedlander, qui les cellules et les tissus devra faire face lorsqu’il est exposé à un événement de véritable explosion. Les systèmes actuels répertoriées dans la littérature incluent choc tubes11,12,13,14,15,16,17, barochambers18,19, la Kolsky bar20, souffle avancé simulateurs21, le Split Hopkinson pression bar22et la reconstitution des événements alternatifs souffle dans un environnement contrôlé à l’aide Tétranitrate de pentaérythrite23. Malgré la vaste gamme de modèles disponibles, plusieurs variables influent sur la blessure provenant des ondes de souffle, y compris le stress avant rapprochée et les propriétés mécaniques des, les types de cellules individuelles ou les tissus sous évaluation24. Alors que l’étude de tissus ou d’organes peut faire la lumière sur la déformation des tissus et des changements morphologiques bruts subies à la suite des événements de souffle, l’analyse au niveau cellulaire peut découvrir transcriptionnelles et épigénétiques changements influencés par l’onde de choc.
Cet article de méthodes décrit une technique pour propager des ondes de choc à une gamme de pressions sur des cellules vivantes dans une monocouche. Cela permet la caractérisation immédiate de la viabilité cellulaire, élucider les seuils de nuisibilité potentielle des ondes de choc. En outre, les cellules viables peuvent être retournés aux conditions de culture standard, et des effets biologiques à long terme de l’événement de souffle peuvent être évaluées. Le protocole ci-dessous décrit deux techniques de viabilité cellulaire qui peuvent être utilisés sur des cellules en culture.
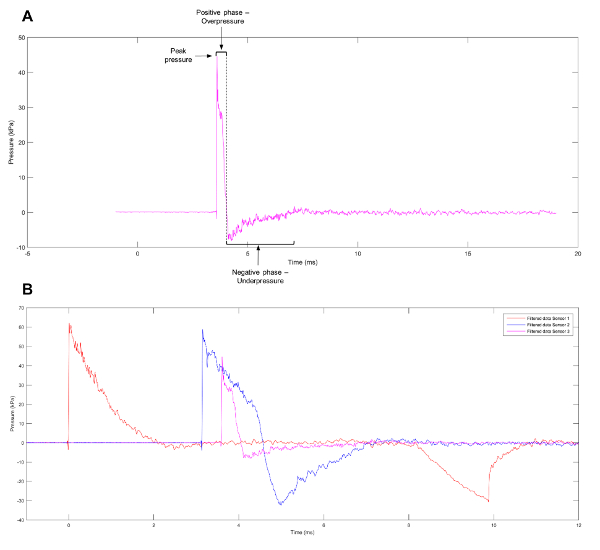
Figure 1 : Rapprochement d’une vague de Friedlander. (A) une approximation d’une vague de Friedlander observée à capteur 3 sur le tube de choc. (B) les données représentatives montrant les profils différents de pression observée à capteurs 1, 2 et 3 sur le tube de choc. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Lésions primaires obtenues contre l’exposition à des événements de l’explosion ne sont pas encore bien comprises. Identifier et comprendre les mécanismes qui déclenchent les blessures induite par le souffle, comme traumatisme cérébral lésion3,4 et ossification hétérotopique6,7, sont importants premiers pas à l’élaboration méthodes efficaces de la prophylaxie. Pour aider à atteindre cet objectif, un certain nombre de systèmes expérimentaux ont été développé pour répliquer blast événement exposition11,12,13,14,18,19 . La technique décrite ici utilise des équipements de tube de choc (Figure 2) capable de tirer des ondes de choc à une gamme de pressions au corps entier (c’est-à-dire, un rongeur), tissu ou échantillons cellulaires. La possibilité de charger les types de cellules individuelles plutôt que des tissus entiers donne la possibilité d’analyser les réponses cellulaires distincts, comme des dommages peuvent survenir en même temps grâce à une gamme de mécanismes1,2. Par exemple, afin de modéliser le traumatisme crânien, l’évaluation des types de cellules individuelles, comme les neurones et les astrocytes, peut permettre pour l’identification des lésions spécifiques des cellules. Aussi, la réponse de l’ensemble d’organes peut être évaluée à l’aide de tissus cérébraux. Aussi bien les types de cellules individuelles et les échantillons de tissus ont une valeur et peuvent donner des informations différentes. Il est également possible de modifier la quantité d’air qui est sous pression pour générer le choc en sélectionnant l’entrée double-culasse ou le tube conducteur. Ceci détermine la durée de l’onde de choc. Une autre possibilité est de changer le matériau et l’épaisseur de modifier la pression de crête25.
Un autre facteur à considérer sont les effets d’interférence fin qui peuvent être présents lorsque le logement de l’échantillon se trouve près de la sortie du tube choc, telle que celle trouvée sur la plate‑forme EVOC décrite dans le système actuel. Chandra et al. regarda blast wave profils retrouvés à différents endroits sur un tube de choc axée sur la compression et que la forme d’onde Friedlander a été mieux représentée à un endroit profondément dans le tube de choc15. Ramos et al. également étudié chargement secondaire de l’échantillon et a conclu que la mise en place d’une plaque d’extrémité à l’extrémité du tube de choc était en mesure d’éliminer les ondes réfléchies indésirables16. Considérant les données trouvées dans ces publications15,16, futures modifications pour améliorer le système de tube de choc décrit dans cet article pourraient impliquer la mise en place de la plate‑forme EVOC à un emplacement plus profondément dans le tube d’entraînement ou, par ailleurs, l’inclusion d’une rondelle d’arrêt sur le tube de choc. Limitations de la méthode décrite pourraient inclure le débit relativement faible des échantillons. Un seul utilisateur peut exploiter le tube de choc en toute sécurité à une production de près de 6-8 échantillons / heure. À l’heure actuelle, le système est conçu autour de l’utilisation de simples plats de Pétri de 35 mm. Des expériences plus grands contenant de multiples groupes et réplicats biologiques peuvent donc s’avérer difficiles à réaliser.
Cet article de méthodes montre comment la viabilité des cellules de la papille dermique adhérentes a été affectée par une exposition à une seule onde de choc. Une onde de choc de courte durée (< 10 ms) du ≤72 kPa n’affecte pas la viabilité par rapport au contrôle (Figure 3 et Figure 4). En revanche, une onde de choc à 127 kPa stimulée par une chute significative de viabilité à post-explosion 24h, comme indiqué par un test d’indicateur rédox (Figure 3) et analyse d’images fluorescentes (Figure 4). Miller et coll. ont signalé une réduction similaire dans la viabilité des cellules dans l’hippocampe organotypiques rat quand les cellules sont exposées à un ou l’autre une 147 kPa ou onde de choc de 278 kPa à l’aide d’un tube de choc à composition non limitée, pilotée par l’hélium14. En revanche, VandeVord et coll. ont signalé qu’il n’a aucun effet sur la viabilité dans les astrocytes de rats exposés à une surpression de courte durée de > 200 kPa, bien qu’un barochamber a été utilisé au lieu d’un tube de choc18. Il est à noter que la pression extérieure est tributaire de l’onde de choc, bien que cela crée des ondes complexes stress au sein de l’organisme, entraînant ainsi la nature du chargement très largement sur les propriétés mécaniques des tissus ou cellules. Des études de caractérisation supplémentaire de la réponse cellulaire aux événements de souffle est nécessaire. En outre, par l’évaluation de l’exposition d’onde de choc au niveau cellulaire, comme le montre cette technique, réponses biologiques déclenchées à partir de la blessure, comme la perturbation de la signalisation des voies ou des changements épigénétiques, peuvent être identifiés et explorés davantage.
En conclusion, cet ouvrage décrit l’utilisation d’un tube de choc en acier inoxydable et un mis à jour le gréement EVOC pour intégrer les cultures de cellules primaires. Ondes de choc à une gamme de pressions peut être générés et propagées sur des cellules vivantes pour reproduire les effets qui se produisent d’une exposition à une onde de choc. Ce protocole montre comment évaluer la viabilité des cellules, mais les changements à long terme à des types de cellules individuelles peuvent également être étudiés. Aller plus loin, nous avons l’intention d’évaluer les effets différentiels qui complexe des ondes de choc peut susciter chez différents types de cellules, dans le but de faire progresser notre compréhension des lésions primaires induite par l’explosion.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous tenons à souligner l’appui financier de la Royal British Legion Centre pour les études de blessure Blast HA et le financement du Conseil de recherches médicales (M01858X/1) à CAH.
Materials
| MEM α, nucleosides | ThermoFisher | 22571020 | |
| Fetal Bovine Serum, certified, US origin | ThermoFisher | 16000044 | Supplement to create complete growth media. |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich | D8537 | |
| Penicillin-Streptomycin | ThermoFisher | 15070-063 | Supplement to create complete growth media. |
| Trypsin-EDTA (0.5%), no phenol red | ThermoFisher | 15400-054 | Dilute 1 in 10 before use. |
| CytoOne T-75 Flask, TC-Treated, vented | Starlab | CC7682-4875 | |
| TC Dish (PS) 35mm, 8.5 cm2 | Triple Red | TCD010035 | |
| Petri dish (PS) 90×14.2mm no vent | VWR UK | 391-0453 | |
| Gas Permeable Adhesive Plate Seals | ThermoFisher | AB-0718 | |
| LIVE/DEAD Cell Imaging Kit (488/570) | ThermoFisher | R37601 | |
| Alamarblue cell viability reagent | Fisher Scientific | 13494309 | |
| Virkon tablets | VWR UK | 115-0020 | Use to create 2% solution as viability control reagent. |
| Dumont forceps | SurgicalTools | 11295-10 | Use to remove coverslips from petri dish. |
| Cover glass, square | VWR UK | 631-0125 | |
| Microscope slides | VWR UK | 631-1553 | |
| 96 Well plate, solid black | AppletonWoods | CC760 | Plate to be used for fluorescence measurements. |
| 96 Well plate, clear, (PS) | VWR UK | 734-1799 | Plate to be used for absorbance measurments. |
| Leica DMi1 Camera stand outfit | Leica Microsystems | Optical microscope used for cell culture. | |
| Zeiss PALM MicroBeam Laser Capture Microdisseciton | Zeiss | Fluorescence microsope used for LIVE/DEAD imaging. | |
| EnVision Multilabel Reader | PerkinElmer | 2104-0010A | Plate reader to be used for fluorescence/absorbance readings. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.023mm | RS Components | 785-0782 | Use to create shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.05mm | RS Components | 785-0786 | Use to creatw shock tube diaphragm. |
| Mylar Electrical & Chemical Insulating Film, 304mm x 200mm x 0.125mm | RS Components | 785-0798 | Use to create shock tube diaphragm. |
| Current source power unit | Dytran Intruments Inc. | 4103C | Power source for 2300V1 sensor. |
| IEPE Pressure Sensor | Dytran Intruments Inc. | 2300V1 | Pressure sensor located on shock tube. |
| Digital Phosphor Oscilloscope | Tektronix | DPO 4104B | Use to gather and save sensor 2300V1 data. |
References
- Proud, W. G. The physical basis of explosion and blast injury processes. J R Army Med Corps. 159, 4-9 (2013).
- Born, C. T. Blast Trauma: The Fourth Weapon of Mass Destruction. Scand J of Surg. 94 (4), 279-285 (2005).
- Kocsis, J. D., Tessler, A. Pathology of blast-related brain injury. J Rehabil Res Dev. 46 (6), 667-671 (2009).
- Bass, C. R., et al. Brain Injuries from Blast. Ann Biomed Eng. 40 (1), 185-202 (2012).
- Cernak, I., Kobeissy, F. H. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Alfieri, K. A., Forsberg, J. A., Potter, B. K. Blast injuries and heterotopic ossification. Bone Joint Res. 1 (8), 174-179 (2012).
- Potter, B. K., Burns, T. C., Lacap, A. P., Granville, R. R., Gajewski, D. A. Heterotopic Ossification Following Traumatic and Combat-Related Amputations. Prevalence, Risk Factors, and Preliminary Results of Excision. J Bone Joint Surg Am. 89 (3), 476-486 (2007).
- Sasser, S. M., Sattin, R. W., Hunt, R. C., Krohmer, J. Blast Lung Injury. Prehosp Emerg Care. 10 (2), 165-172 (2006).
- Cho, S. -. I., et al. Mechanisms of Hearing Loss after Blast Injury to the Ear. PLoS ONE. 8 (7), 67618 (2013).
- Bull, M. A., Clasper, J., Mahoney, P. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , (2016).
- Arun, P., et al. Studies on blast traumatic brain injury using in-vitro model with shock tube. Neuroreport. 22 (8), 379-384 (2011).
- Ahlers, S. T., et al. Assessment of the effects of acute and repeated exposure to blast overpressure in rodents: toward a greater understanding of blast and the potential ramifications for injury in humans exposed to blast. Front Neurol. 3, 32 (2012).
- Polfer, E. M., et al. The development of a rat model to investigate the formation of blast-related post-traumatic heterotopic ossification. Bone Joint J. 97 (4), 572-576 (2015).
- Miller, A. P., et al. Effects of Blast Overpressure on Neurons and Glial Cells in Rat Organotypic Hippocampal Slice Cultures. Front Neurol. 6, 20 (2015).
- Chandra, N., et al. Evolution of blast wave profiles in simulated air blasts: experiment and computational modeling. Shock Waves. 22 (5), 403-415 (2012).
- Kuriakose, M., et al. Tailoring the Blast Exposure Conditions in the Shock Tube for Generating Pure, Primary Shock Waves: The End Plate Facilitates Elimination of Secondary Loading of the Specimen. PLoS ONE. 11 (9), 0161597 (2016).
- Reneer, D. V., et al. A Multi-Mode Shock Tube for Investigation of Blast-Induced Traumatic Brain Injury. J Neurotrauma. 28 (1), 95-104 (2011).
- VandeVord, P. J., et al. Up-regulation of reactivity and survival genes in astrocytes after exposure to short duration overpressure. Neurosci Lett. 434 (3), 247-252 (2008).
- Kane, M. J., et al. Altered gene expression in cultured microglia in response to simulated blast overpressure: Possible role of pulse duration. Neurosci Lett. 522 (1), 47-51 (2012).
- Nienaber, M., Lee, J. S., Feng, R., Lim, J. Y. Impulsive pressurization of neuronal cells for traumatic brain injury study. J Vis Exp. (56), (2011).
- Zhang, J., et al. Transcriptional Profiling in Rat Hair Follicles following Simulated Blast Insult: A New Diagnostic Tool for Traumatic Brain Injury. PLoS ONE. 9 (8), 104518 (2014).
- Bo, C., et al. Cellular characterization of compression-induceddamage in live biological samples. AIP Conf Proc. 1426 (1), 153-156 (2012).
- Tannous, O., Griffith, C., O’Toole, R. V., Pellegrini, V. D. Heterotopic ossification after extremity blast amputation in a Sprague-Dawley rat animal model. J Orthop Trauma. 25 (8), 506-510 (2011).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-Vitro Approaches for Studying Blast-Induced Traumatic Brain Injury. J Neurotrauma. 26 (6), 861-876 (2009).
- Nguyen, T. T. N., Wilgeroth, J. M., Proud, W. G. Controlling blast wave generation in a shock tube for biological applications. JPCS. 500 (14), 142025 (2014).

