Oesofageale warmteoverdracht voor patiënt temperatuurregeling en gerichte temperatuur Management
Summary
Deze studie presenteert een nieuwe methode om efficiënte patiënt temperatuurregeling voor koelen of verwarmen van patiënten. Een eenmalig gebruik, triple lumen apparaat wordt geplaatst in de slokdarm, analoog aan een standaard orogastric buis, en verbindt met bestaande warmtewisselaars voor het uitvoeren van de automatisch patiënt temperatuur beheer.
Abstract
Beheersing van de patiënt temperatuur is belangrijk voor een breed scala aan klinische omstandigheden. Koeling naar normaal of onder normale lichaamstemperatuur wordt vaak uitgevoerd voor neuroprotectie na ischemische belediging (bijvoorbeeld hemorragische beroerte, subarachnoïdale bloeding, hartstilstand of ander hypoxische letsel). Koeling met behulp van koorts staten behandelt de koorts en vermindert de negatieve gevolgen van hyperthermie voor gewonde neuronen. Patiënten worden opgewarmd in de operatiekamer om te voorkomen dat onbedoelde perioperatieve hypothermie, die erom bekend te veroorzaken meer bloedverlies en wond infecties myocardiale letsel, terwijl ook verlenging van de hersteltijd. Er zijn vele gerapporteerde benaderingen voor het beheer van de temperatuur, met inbegrip van geïmproviseerde methoden dat hergebruiken standaard levert (bijvoorbeeldijs, gekoeld saline, fans, dekens), maar meer geavanceerde technologieën die zijn ontwikkeld voor het beheer van de temperatuur zijn meestal meer succes in het leveren van een geoptimaliseerde protocol. Het laatste decennium, geavanceerde technologieën rond twee warmte overdracht methoden hebben ontwikkeld: oppervlakte apparaten (water dekens, gedwongen-lucht warmers) of intravasculaire apparaten (steriele katheters waarvoor vasculaire plaatsing). Onlangs, een nieuw apparaat Sonett dat is geplaatst in de slokdarm, analoog aan een standaard orogastric buis, die zorgt voor efficiënte warmteoverdracht door de kern van de patiënt. Het apparaat is aangesloten op de bestaande warmtewisselaars om automatische patiënt temperatuur beheer via een servo-mechanisme, met behulp van de patiënt temperatuur van standaard temperatuursensoren (rectaal, Foley, of andere kern temperatuursensoren) als de invoervariabele. Deze benadering elimineert de plaatsing van de vasculaire complicaties (diepe veneuze trombose, centrale lijn verbonden bloedbaan infecties), vermindert de obstructie op patiënten toegang en veroorzaakt minder rillen in vergelijking met oppervlakte benaderingen. Gepubliceerde gegevens gebleken ook een hoge graad van nauwkeurigheid en het onderhoud van doel temperatuur met behulp van de esophageal benadering voor het managen van de temperatuur. Daarom is het doel van deze methode om een alternatieve methode van laag-risicomateriaal voor controlerende patiënt temperatuur in kritieke zorg instellingen.
Introduction
Er is aanzienlijke behoefte van de patiënt temperatuur beheer bij de behandeling van een brede waaier van voorwaarden, met inbegrip van hartstilstand, vuurvaste of terugkerende koorts, neurogene koorts en grote operatie. In de Verenigde Staten, een half miljoen cardiac arrestaties jaarlijks afkomstig zijn uit het ziekenhuis of in het ziekenhuis (bijvoorbeeld bij patiënten die zorg voor algemene medische of chirurgische omstandigheden ondergaan)1 (bijvoorbeeld, thuis of in openbare plaatsen, die komen vervolgens naar het departement van de noodsituatie)2. In beide scenario’s, zijn geduldige resultaten aanzienlijk verbeterd wanneer actieve temperatuur beheer door de overheid gereguleerde3 is en gerichte temperatuur management (TTM) is sinds 2005 een norm van care for hartstilstand. Meer dan 5 miljoen patiënten zijn intensieve zorg eenheden per jaar in de VS4 opgenomen. Van deze, koorts ontwikkelt tot 45% van de niet-neurologisch gewonde patiënten5 en maar liefst 70% van de neurologisch gewonde patiënten6. Koorts controle op de intensive care is geassocieerd met betere uitkomsten en minder risico op overlijden, omdat de temperatuur verhoogt de metabole eisen, verergert cerebrale ischemie en verhoogt de neuronale verlies7. Ten minste 10 miljoen operaties per jaar uitgevoerd in de VS vereist actieve patiënt opwarming van de aarde om te voorkomen dat onbedoelde perioperatieve hypothermie8. In de operatiekamer, moeten patiënten die een operatie ondergaan handhaven een lichaamstemperatuur boven de 36 ° C om te voorkomen dat een groot aantal bijwerkingen. Ongeplande dalingen in lichaamstemperatuur vóór, tijdens of na chirurgie verhoging bloed verlies, infecties en ziekenhuis lengte van verblijf, die 7.000 dollar toevoegt of meer per patiënt tot ziekenhuisopname kost9,10,11 ,12.
Ondanks grote klinische behoefte, de meest door de overheid gereguleerde temperatuur-beheerprotocollen aantonen van onvoldoende prestaties of significant risico kennismaken met de patiënt. Oppervlakte apparaten (zoals water dekens, geleiding matrassen en gedwongen-air covers) omslachtig zijn, hebben beperkte overdracht warmtecapaciteit, en moeten worden verwijderd zodat toegang hebben tot de patiënt voor patiëntenzorg en procedures. Intravasculaire apparatuur zijn invasieve en moeilijk te plaatsen, en patiënten predisponeren voor infecties en bloedstolsels. Bestaande benaderingen ter voorkoming van onbedoelde perioperatieve hypothermie mislukken om normothermia tot 70% van de tijd12,13,14,15,16 en een retrospectieve analyse van post cardiale arrestatie koeling gevonden dat de totale, 30% van de patiënten niet tot doel temperatuur binnen 6 uur17.
De oesofageale benadering voor het managen van de patiënt temperatuur biedt aanzienlijke voordelen aan bestaande technologieën18. Het apparaat oesofageale temperatuur beheer onderhoudt de functionaliteit van de maag buis meestal geplaatst in kritieke zorg en chirurgische patiënt populaties. Daardoor continu maag zuig- en decompressie van gas en vloeistoffen terwijl het toevoegen van de mogelijkheid om controle van een patiënt temperatuur veilig en efficiënt door gebruik te maken van de gunstige warmte exchange-omgeving van de slokdarm (Figuur 1). Temperatuur modulatie wordt bereikt door het oesofageale temperatuur beheer apparaat te koppelen aan een van verschillende externe warmtewisselaars (ook wel Waterkoelaggregaten genoemd) die gebruikmaken van water als de koelvloeistof. Verschillende leveranciers produceren compatibel warmtewisselaars die beschikbaar in ziekenhuizen zijn voor het voeden van bestaande temperatuur controle producten (meestal water dekens). Verpleegkundigen, nurse practitioners of artsen meestal een oesofageale temperatuur beheer apparaat plaatsen, maar deze kan ook worden ingevoegd door een willekeurige provider opgeleid om een standaard orogastric buis. Het oesofageale temperatuur beheer apparaat niet beperkt toegang tot de patiënt, hoeft niet te worden steriel, vermijdt het risico van naald stick verwondingen tussen aanbieders en vermijdt de risico’s van de huid complicaties, bloedbaan infecties en bloedstolsels in de patiënt. Daarom is het doel van deze methode om een alternatieve methode van laag-risicomateriaal voor het beheersen van de patiënt temperatuur in kritieke zorg en operatiekamer instellingen.
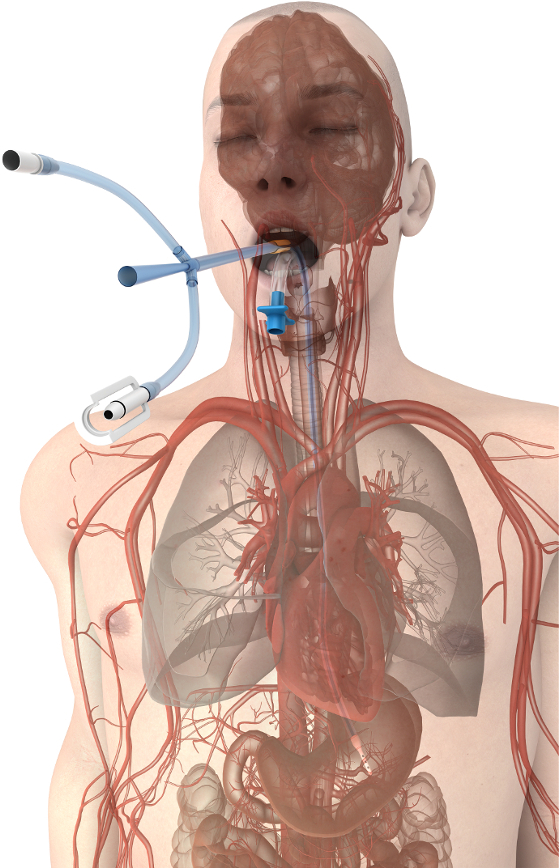
Figuur 1. Oesofageale temperatuur beheer apparaat plaatsing. De nabijheid van het apparaat naar de grote schepen en het hart bevorderen efficiënte warmteoverdracht kern van de patiënt. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
Wijziging en probleemoplossing vereist voor dit protocol is over het algemeen beperkt tot die featured hierboven, en omvat de typische monitoring van patiëntenzorg werkzaam in kritieke zorg instellingen. Modulerende kerntemperatuur is cruciaal voor patiëntenoutcomes in een groeiend aantal klinische scenario’s. Deze omvatten de opzettelijke inductie van onderkoeling van normothermia, opwarmen van onbedoelde of opzettelijke hypothermie, en in welke onbedoelde hypothermie actief handhaven van de normale lichaamstemperatuur (d.w.z. normothermia) tijdens voorwaarden zijn gemeenschappelijk, zoals in de operatiekamer. Als specifieke klinische voorbeelden, patiënten die ischemie-reperfusie schade lijden, zoals optreedt tijdens hartstilstand, profiteren van het afkoelen (in het algemeen tot temperaturen lager dan normale lichaamstemperatuur) gevolgd door zachte opwarmen en koorts preventie voor maximaal 3 dagen na reanimatie28,29,30. Pasgeborenen hypoxische ischemische encefalopathie lijden krijgen betere resultaten als gekoeld onder normale lichaam temperatuur31. Het koelen van donoren van de nier na neurologische dood, voorafgaand aan orgaantransplantatie, heeft aangetoond dat het verminderen van het aantal vertraagde graft functie32. Beheersing van koortsen bij septische shock patiënten kan verminderen doser vereisten en bijdragen tot een vermindering van vroegtijdige sterfte33. Handhaving van normothermia bij patiënten chirurgische ingrepen ondergaan vermindert chirurgische wond infecties, myocardiale complicaties, bloedverlies en transfusiedoeleinden, terwijl de duur van het verblijf verkorten en verminderen de kans op overlijden10 , 11 , 16.
Beperkingen van de techniek zijn uitdagingen die zich voordoen bij het beheren van kritische zorg patiënten. Terwijl gerichte temperatuur beheer goede resultaten bevordert, kennismaken de meest voorkomende temperatuur modulatietechnieken met risico’s patiënten en logistieke uitdagingen aan aanbieders (met inbegrip van problemen in plaatsing, infecties van de bloedbaan, bloedstolsels, huid schade en kosten). Oesofageale temperatuur beheer is ontworpen voor het overwinnen van deze tekortkomingen34,35,,36. Wanneer op de juiste manier beheerd, komt het oesofageale temperatuur beheer apparaat niet in contact met de therapieën (net als de intravasculaire temperatuur modulatie apparaten) of de huid (zoals de oppervlaktetemperatuur modulatie apparaten), aldus voorkomen dat de bloedstolsels bloedbaan infectie en aantasting van de huid. Het apparaat kan snel worden geplaatst door een verscheidenheid van zorgaanbieders, meestal in een kwestie van minuten21,37. De invoegpositie techniek bootst standaard orogastric buis plaatsing, die werkstroom verstoringen die therapie initiatie vertragen minimaliseert. Met behulp van een kern-aanpak lijkt ook te poseren aanzienlijk minder shivering last dan oppervlak27,38,39,40 benadert . Dit heeft het voordeel van vermindering van kalmerend middel en anti-rillen medicatie kosten, die dan verkort de patiënt verblijfsduur via sneller ontwaken van de lagere graad van sedatie vereist. Deze, geacht in onderling overleg met de klinische prestaties die hierboven beschreven, eigenschappensteun oesofageale temperatuur beheer als een haalbare optie voor aanbieders in de noodsituatie afdeling intensive care afdeling en de operatiekamer. Een groeiend aantal gegevens gepubliceerd op het apparaat ondersteunt eveneens deze nieuwe aanpak21,22,23,24,27,41.
Kritische stappen binnen het protocol opnemen starten stroom binnen het apparaat vóór inbrengen, waarbij voldoende smering om het apparaat om het verzekeren van gemakkelijke plaatsing, uitvoeren van maag suctioning en decompressie dat maximale contact tussen apparaat en patiënt, en het aanpakken van elke patiënt rillen die kunnen ontwikkelen. Volgens dit protocol zal bieden optimale resultaten en een hoge mate van de prestaties en veiligheid in de zorg voor deze belangrijke populatie toestaan.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Geen.
Materials
| EnsoETM | Attune Medical | ECD01 | Device compatible with Gaymar/Stryker Medi-Therm III and Stryker Altrix Precision Temperature Management System |
| EnsoETM | Attune Medical | ECD02 | Device compatible with Cincinnati SubZero Blanketrol II and Cincinnati SubZero Blanketrol III |
| Gaymar/Stryker Medi-Therm III | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Cincinnati SubZero Blanketrol II | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Cincinnati SubZero Blanketrol III | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Stryker Altrix Precision Temperature Management System | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Water-soluble lubricant | Various | n/a | Standard water-soluble lubricant used to ease insertion of tubes, catheters, and digits |
| Securement device | Various | n/a | E.g., Guard360 by PrimeGuard Medical |
References
- Chan, P. S., Krumholz, H. M., Nichol, G., Nallamothu, B. K. Delayed time to defibrillation after in-hospital cardiac arrest. N Engl J Med. 358 (1), 9-17 (2008).
- Callans, D. J. Out-of-Hospital Cardiac Arrest — The Solution Is Shocking. N Engl J Med. 351 (7), 632-634 (2004).
- Kochanek, P. M., Jackson, T. C. The Brain and Hypothermia-From Aristotle to Targeted Temperature Management. Crit Care Med. 45 (2), 305-310 (2017).
- Laupland, K. B., et al. Occurrence and outcome of fever in critically ill adults. Crit Care Med. 36 (5), 1531-1535 (2008).
- Diringer, M. N., Reaven, N. L., Funk, S. E., Uman, G. C. Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients. Critical Care Medicine. 32 (7), 1489-1495 (2004).
- Laupland, K. B. Fever in the critically ill medical patient. Critical care medicine. 37 (Suppl 7), S273-S278 (2009).
- Mathias, J. M. Hospitals to report on normothermia. OR manager. 25 (9), 22-24 (2009).
- Rajagopalan, S., Mascha, E., Na, J., Sessler, D. I. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 108 (1), 71-77 (2008).
- Kurz, A., Sessler, D. I., Lenhardt, R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med. 334 (19), 1209-1215 (1996).
- Sessler, D. I. New surgical thermal management guidelines. Lancet. 374 (9695), 1049-1050 (2009).
- Young, V. L., Watson, M. E. Prevention of perioperative hypothermia in plastic surgery. Aesthet Surg J. 26 (5), 551-571 (2006).
- Hedrick, T. L., et al. Efficacy of protocol implementation on incidence of wound infection in colorectal operations. J Am Coll Surg. 205 (3), 432-438 (2007).
- Forbes, S. S., et al. Implementation of evidence-based practices for surgical site infection prophylaxis: results of a pre- and postintervention study. J Am Coll Surg. 207 (3), 336-341 (2008).
- Sun, Z., et al. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 122 (2), 276-285 (2015).
- Leary, M., et al. The association of body mass index with time to target temperature and outcomes following post-arrest targeted temperature management. Resuscitation. 85 (2), 244-247 (2014).
- Naiman, M., Shanley, P., Garrett, F., Kulstad, E. Evaluation of advanced cooling therapy’s esophageal cooling device for core temperature control. Expert Rev Med Devices. 13 (5), 423-433 (2016).
- Naiman, M., Markota, A., Hegazy, A. F., Dingley, J., Kulstad, E. Temperature Management in Critical Care and Burn Patients using an Esophageal Heat Transfer Device. Military Medicine. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Althenayan, E. Temperature control in critically ill patients with a novel esophageal cooling device: a case series. BMC Anesthesiol. 15, 152 (2015).
- Bukovnik, N., Markota, A., Velnar, T., Rebol, J., Sinkovic, A. Therapeutic hypothermia and inhalation anesthesia in a patient with severe pneumococcal meningitis and secondary cardiac arrest. Am J Emerg Med. 35 (4), 665.e665-665.e666 (2017).
- Markota, A., Fluher, J., Kit, B., Balazic, P., Sinkovic, A. The introduction of an esophageal heat transfer device into a therapeutic hypothermia protocol: A prospective evaluation. Am J Emerg Med. 34 (4), 741-745 (2016).
- Markota, A., Kit, B., Fluher, J., Sinkovic, A. Use of an oesophageal heat transfer device in therapeutic hypothermia. Resuscitation. 89, e1-e2 (2015).
- Schroeder, D. C., et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management. PLoS One. 12 (3), e0173229 (2017).
- Williams, D., et al. Use of an Esophageal Heat Exchanger to Maintain Core Temperature during Burn Excisions and to Attenuate Pyrexia on the Burns Intensive Care Unit. Case Reports in Anesthesiology. 2016, 6 (2016).
- Khan, I., et al. . 14th Annual Neurocritical Care Society Meeting. , (2016).
- HACA. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 346 (8), 549-556 (2002).
- Bernard, S. A., et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 346 (8), 557-563 (2002).
- Callaway, C. W., et al. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S465-S482 (2015).
- Wyckoff, M. H., et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S543-S560 (2015).
- Niemann, C. U., et al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 373 (5), 405-414 (2015).
- Schortgen, F., et al. Fever control using external cooling in septic shock: a randomized controlled trial. Am J Respir Crit Care Med. 185 (10), 1088-1095 (2012).
- Reccius, A., Mercado, P., Vargas, P., Canals, C., Montes, J. Inferior Vena Cava Thrombosis Related to Hypothermia Catheter: Report of 20 Consecutive Cases. Neurocrit Care. 23 (1), 72-77 (2015).
- Maze, R., et al. Endovascular cooling catheter related thrombosis in patients undergoing therapeutic hypothermia for out of hospital cardiac arrest. Resuscitation. 85 (10), 1354-1358 (2014).
- Simosa, H. F., Petersen, D. J., Agarwal, S. K., Burke, P. A., Hirsch, E. F. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg. 73 (5), 461-464 (2007).
- Kulstad, E., et al. Induction, maintenance, and reversal of therapeutic hypothermia with an esophageal heat transfer device. Resuscitation. 84 (11), 1619-1624 (2013).
- van Zanten, A. R., Polderman, K. H. Blowing hot and cold? Skin counter warming to prevent shivering during therapeutic cooling. Crit Care Med. 37 (6), 2106-2108 (2009).
- Tommasi, E., et al. Cooling techniques in mild hypothermia after cardiac arrest. J Cardiovasc Med. , (2014).
- Diringer, M. N. Treatment of fever in the neurologic intensive care unit with a catheter-based heat exchange system. Crit Care Med. 32 (2), 559-564 (2004).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. 46 (3), 143-148 (2017).

