העברת החום הוושט עבור בקרת טמפרטורה המטופל וניהול הטמפרטורה יישוב
Summary
מחקר זה מציג שיטה לספק בקרת טמפרטורה החולה יעיל עבור קירור או חימום חולים. שימוש אחד, מתקן ההזרקה מושם לתוך הוושט, מקביל הזונדה סטנדרטי, ומתחבר החום הקיים המרת יחידות כדי לבצע ניהול טמפרטורה החולה אוטומטית.
Abstract
בטמפרטורה החולה חשוב עבור מגוון רחב של מצבים קליניים. קירור רגיל או מתחת לטמפרטורת הגוף נורמלי מבוצע לעתים קרובות על neuroprotection לאחר עלבון איסכמי (למשל שבץ מדמם, דימום תת-עכבישי, דום לב או פציעה לפציעה hypoxic אחרים). קירור ממדינות קודח מתייחס חום ומפחית את ההשפעות השליליות של היפרתרמיה על הנוירונים פצועים. המטופלים הם חימם בחדר הניתוח כדי למנוע היפותרמיה perioperative בהיסח הדעת, אשר ידוע כגורם איבוד דם מוגבר, הפצע דלקות שריר הלב פגיעה, תוך כדי גם להאריך את זמן ההחלמה. קיימות גישות רבות שבהן דווח על ניהול טמפרטורה, כולל שיטות מאולתר כי הייעוד של תקן מספקת (למשל, קרח, תמיסת מלח צוננת, מאווררים, שמיכות) אבל הם טכנולוגיות מתוחכמות יותר שנועד לניהול טמפרטורה בדרך כלל מוצלחים יותר בתחום אספקת פרוטוקול ממוטבת. במהלך העשור האחרון, טכנולוגיות מתקדמות פיתחו שיטות העברת חום סביב שני: משטח התקנים (שמיכות, כפה-אייר מחממי מים) או התקנים קרישה תוך-כלית (קטטרים סטריליים המחייב הצבת כלי הדם). לאחרונה, מכשיר הרומן הפך זמין זה להציב את הוושט, מקביל הזונדה סטנדרטי, המספק העברת חום יעיל דרך הליבה של המטופל. המכשיר מתחבר קיים חום המרת יחידות כדי לאפשר ניהול אוטומטי טמפרטורה החולה באמצעות מנגנון סרוו, באמצעות הטמפרטורה החולה מ חיישני טמפרטורה רגיל (רקטלי, פולי, או אחר ליבה חיישני טמפרטורה) כמו המשתנה קלט. גישה זו מבטלת סיבוכים מיקום כלי דם (פקקת ורידים עמוקה, הקו המרכזי הקשורים למחזור הדם זיהום), מפחיתה את חסימת גישה סבלנית, וגורם פחות רועד כאשר לעומת גישות משטח. נתונים שפורסמו גם הראו רמה גבוהה של דיוק ותחזוקה של טמפרטורת היעד באמצעות גישה הוושט לניהול טמפרטורה. לכן, מטרת שיטה זו היא לספק שיטה חלופית של סיכון נמוך טמפרטורה החולה לשליטה בהגדרות לטיפול נמרץ.
Introduction
יש צורך משמעותי לניהול טמפרטורת החולה לטיפול במגוון רחב של מחלות, כולל דום, חסיני אש או חום חוזרות, קדחת neurogenic ניתוח רציני. בארצות הברית, מעצרים הלב חצי מיליון בשנה מקורם של בית החולים (לדוגמה, אצל חולים אשר עוברים טיפול עבור תנאים כלליים רפואית או כירורגית)1 או מבית החולים (לדוגמה, בבית או באולמות ציבוריים, מי מכן מובאים למחלקת המיון)2. בשני התרחישים, תוצאות המטופל באופן משמעותי שיפור כאשר ניהול לטמפרטורה פעיל בניהול3 ניהול ממוקד טמפרטורה (TTM) היה תקן של טיפול דום מאז 2005. מעל 5 מליון חולים מאושפזים יחידות טיפול נמרץ מדי שנה ב בארה ב4 . אלה, חום מתפתח עד 45% של חולים שאינם נוירולוגית פצוע5 ועד 70% של חולים הפגוע נוירולוגית6. בקרת חום נמרץ מזוהה עם תוצאות משופרות וסיכון מופחת של מוות, כי טמפרטורות גבוהות מגבירה את דרישות המטבולית, מחמיר קליפתית ומגביר את אובדן עצביים7. לפחות 10 מיליון ניתוחים שבוצעו בשנה בארה ב דורשים חימום המטופל פעיל כדי למנוע היפותרמיה בהיסח הדעת perioperative8. בחדר הניתוח, חולים שעברו ניתוח צריך לשמור על טמפרטורת גוף מעל 36 ° C כדי למנוע מספר רב של תופעות לוואי. ירידות לא מתוכנן טמפרטורת הגוף לפני, במהלך או לאחר ניתוח להגדיל דם, זיהומים, ואובדן של בית החולים אורך השהייה, המוסיף 7,000 דולר או יותר לכל מטופל אשפוז עולה9,10,11 ,12.
למרות צורך קליני גדול, הפרוטוקולים ניהול נרחב ביותר בניהול טמפרטורה להפגין ביצועים לקוי או להציג סיכונים משמעותיים למטופל. משטח התקנים (כגון מים שמיכות, מזרונים הולכה, כריכות בכפייה-אייר) מסורבלת, מוגבלת קיבולת העברת חום, להסירו כדי לאפשר גישה המטופל לקבלת טיפול בחולה ונהלים. קרישה תוך-כלית התקני הם פולשניים, קשה למקם ולאחר predispose חולים זיהומים, קרישי דם. גישות קיימות כדי למנוע היפותרמיה perioperative בהיסח הדעת להיכשל לשמור על normothermia עד ל-70% של ה זמן12,13,14,15,16 , ניתוח רטרוספקטיבי מעצר לב שלאחר קירור למצוא את הכללי, 30% מהחולים לא הצליחה להגיע אל היעד הטמפרטורה בתוך 6-אייץ ‘17.
הגישה הוושט לניהול טמפרטורת החולה מציעה יתרונות משמעותיים טכנולוגיות קיימות18. המכשיר ניהול טמפרטורת הוושט שומרת על הפונקציונליות של הצינור קיבה בדרך כלל במחלקה לטיפול נמרץ ואוכלוסיות החולה כירורגי. היא מאפשרת יניקה קיבה מתמשך וביטול דחיסה של גז ונוזלים תוך הוספת היכולת לשלוט בטמפרטורה של החולה בבטחה וביעילות באמצעות מינוף הסביבה המרת חום חיובית של הוושט (איור 1). טמפרטורה אפנון מושגת על-ידי חיבור המכשיר ניהול טמפרטורת הוושט לכל אחד מספר חיצוני מחליפי חום (נקרא גם צ’ילרים) המשתמשות במים כמו הקירור. מספר ספקי לייצר מחליפי חום תואם הזמינות בבתי חולים להפעלת מוצרים קיימים בקרת טמפרטורה (לרוב מים שמיכות). אחיות, מטפלים או רופאים בדרך כלל מקום התקן לניהול טמפרטורת הוושט, אבל זה גם יכול להיות מוכנס על-ידי כל ספק מאומנים כדי למקם את הזונדה סטנדרטי. המכשיר ניהול טמפרטורת הוושט לא להגביל את הגישה לחולה, לא צריך להיות סטרילי, מונע את הסיכון מפציעות מקל מחט בין ספקי, וימנע את הסיכונים של העור סיבוכים, זיהומים למחזור הדם, קרישי דם אצל המטופל. לכן, מטרת שיטה זו היא לספק שיטה חלופית סיכון נמוך בטמפרטורה החולה בהגדרות חדר הניתוח והטיפול קריטי.
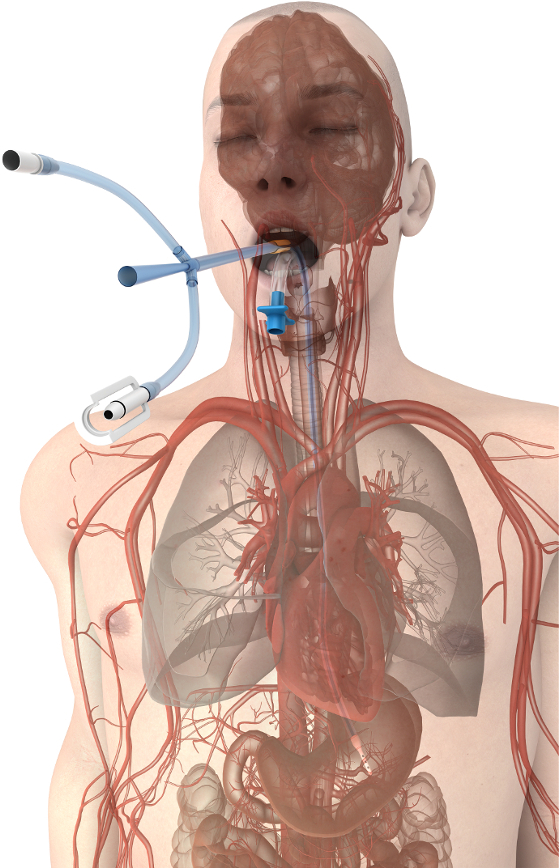
איור 1. מיקום המכשיר ניהול טמפרטורת הוושט. התקן מהקרבה כלי נהדר והלב לקדם את העברת החום יעיל בליבה של המטופל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
Representative Results
Discussion
השינוי ופתרון הנדרש עבור פרוטוקול זה בדרך כלל מוגבלת בהשתתפות מעל, כרוך בקרה טיפוסי של טיפול בחולה המועסקים במסגרות לטיפול נמרץ. הכוח ויסות טמפרטורת חיוני תוצאות המטופל במגוון הולך וגדל של תרחישים קליניים. אלה כוללים את תנאי הגיוס מכוונת של היפותרמיה מן normothermia, להפשיר אותו מהיפותרמיה בהיסח הדעת או מכוונת, ולא באופן פעיל שמירה על טמפרטורת גוף נורמלית (קרי: normothermia) במהלך תנאים ב אילו היפותרמיה בהיסח הדעת? נפוץ, כגון בחדר הניתוח. כדוגמאות קליני מסוים, חולים אשר סובלים פגיעה reperfusion-איסכמיה פציעה, כגון מתרחשת במהלך דום לב, תועלת קירור (בדרך כלל לטמפרטורות מתחת לטמפרטורת הגוף רגיל) ואחריו עדין להפשיר אותו חום ומניעת עד 3 ימים לאחר החייאה28,29,30. Neonates סובל מחוסר חמצן אנצפלופתיה איסכמי להשיג תוצאות משופרות אם מתחת טמפרטורת גוף נורמלי31. הקירור של תורמים כליה לאחר מותו נוירולוגיים, לפני השתלת איברים, הוכח להקטין את הקצב של תפקוד שתל מאוחרת32. שליטה חום בחולים להלם זיהומי עשוי להפחית את דרישות vasopressor עוצמה של התורמים להפחתת התמותה המוקדמת33. שמירה על normothermia בחולים שעברו ניתוחים מפחית זיהומים בפצע הניתוח, סיבוכים שריר הלב, אובדן הדם ודרישות עירוי, תוך קיצור אורך השהייה, להפחית את הסבירות. של מוות10 , 11 , 16.
מגבלות של הטכניקה כוללים אתגרים נתקלה בניהול חולים לטיפול נמרץ. בעוד הטמפרטורה יישוב ניהול מקדמת תוצאות טובות, הטכניקות הנפוצות ביותר של אפנון טמפרטורה להציג סיכונים חולים ואתגרים לוגיסטי לספקי (לרבות קשיים השמה, זיהומים למחזור הדם, קרישי דם, נזק לעור, ועלות). ניהול טמפרטורת הוושט נועד להתגבר על אלה חסרונות34,35,36. כאשר מנוהל כראוי, המכשיר ניהול טמפרטורת הוושט בא במגע עם להערכת (כמו לעשות הטמפרטורה קרישה תוך-כלית אפנון התקנים) או עור (כמו לעשות טמפרטורת פני השטח אפנון התקנים), ובכך למנוע קרישי דם, זיהום הדם והשפלות העור. ניתן להציב את המכשיר במהירות על ידי מגוון רחב של ספקי שירותי הבריאות, בדרך כלל תוך מספר דקות21,37. הטכניקה ההכנסה מחקה מיקום צינור orogastric סטנדרטי, אשר ממזער הפרעות בזרימת העבודה שעלולה לעכב טיפול חניכה. שימוש בגישה הליבה מופיע גם לדגמן באופן משמעותי פחות התגוננות נטל מאשר השטח מתקרב27,–38,–39,–40 . זה יש את היתרון של הפחתת הרגעה, תרופות אנטי-רועד עולה, אשר לאחר מכן מקצר את אורך השהייה באמצעות התעוררות מהירה יותר של מידת התחתונה הרגעה נדרש המטופל. תכונות אלה, נחשב בהופעה עם ההופעה הקלינית שתוארה לעיל, תמיכה וניהול הטמפרטורה הוושט בתור אופציה בת קיימא ספקי מחלקת המיון, יחידת טיפול נמרץ, חדר ניתוח. ערכת גידול נתונים שפורסמו על המכשיר תומך כנ ל זו החדש הגישה21,22,23,24,27,41.
שלבים קריטיים בתוך הפרוטוקול כוללים ייזום זרימת בתוך המכשיר לפני הכניסה, מתן שימון הולם על ההתקן כדי להבטיח מיקום קל, ביצוע suctioning קיבה וביטול דחיסה כדי לאפשר מגע מרבי בין המכשיר, החולה, ואת כתובות כל מטופל רועד זה עלול להתפתח. בעקבות פרוטוקול זה לספק תוצאות מיטביות ולאפשר רמה גבוהה של ביצועים ובטיחות בטיפול של האוכלוסייה המטופלת החשוב הזה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
. לא-
Materials
| EnsoETM | Attune Medical | ECD01 | Device compatible with Gaymar/Stryker Medi-Therm III and Stryker Altrix Precision Temperature Management System |
| EnsoETM | Attune Medical | ECD02 | Device compatible with Cincinnati SubZero Blanketrol II and Cincinnati SubZero Blanketrol III |
| Gaymar/Stryker Medi-Therm III | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Cincinnati SubZero Blanketrol II | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Cincinnati SubZero Blanketrol III | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Stryker Altrix Precision Temperature Management System | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Water-soluble lubricant | Various | n/a | Standard water-soluble lubricant used to ease insertion of tubes, catheters, and digits |
| Securement device | Various | n/a | E.g., Guard360 by PrimeGuard Medical |
References
- Chan, P. S., Krumholz, H. M., Nichol, G., Nallamothu, B. K. Delayed time to defibrillation after in-hospital cardiac arrest. N Engl J Med. 358 (1), 9-17 (2008).
- Callans, D. J. Out-of-Hospital Cardiac Arrest — The Solution Is Shocking. N Engl J Med. 351 (7), 632-634 (2004).
- Kochanek, P. M., Jackson, T. C. The Brain and Hypothermia-From Aristotle to Targeted Temperature Management. Crit Care Med. 45 (2), 305-310 (2017).
- Laupland, K. B., et al. Occurrence and outcome of fever in critically ill adults. Crit Care Med. 36 (5), 1531-1535 (2008).
- Diringer, M. N., Reaven, N. L., Funk, S. E., Uman, G. C. Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients. Critical Care Medicine. 32 (7), 1489-1495 (2004).
- Laupland, K. B. Fever in the critically ill medical patient. Critical care medicine. 37 (Suppl 7), S273-S278 (2009).
- Mathias, J. M. Hospitals to report on normothermia. OR manager. 25 (9), 22-24 (2009).
- Rajagopalan, S., Mascha, E., Na, J., Sessler, D. I. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 108 (1), 71-77 (2008).
- Kurz, A., Sessler, D. I., Lenhardt, R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med. 334 (19), 1209-1215 (1996).
- Sessler, D. I. New surgical thermal management guidelines. Lancet. 374 (9695), 1049-1050 (2009).
- Young, V. L., Watson, M. E. Prevention of perioperative hypothermia in plastic surgery. Aesthet Surg J. 26 (5), 551-571 (2006).
- Hedrick, T. L., et al. Efficacy of protocol implementation on incidence of wound infection in colorectal operations. J Am Coll Surg. 205 (3), 432-438 (2007).
- Forbes, S. S., et al. Implementation of evidence-based practices for surgical site infection prophylaxis: results of a pre- and postintervention study. J Am Coll Surg. 207 (3), 336-341 (2008).
- Sun, Z., et al. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 122 (2), 276-285 (2015).
- Leary, M., et al. The association of body mass index with time to target temperature and outcomes following post-arrest targeted temperature management. Resuscitation. 85 (2), 244-247 (2014).
- Naiman, M., Shanley, P., Garrett, F., Kulstad, E. Evaluation of advanced cooling therapy’s esophageal cooling device for core temperature control. Expert Rev Med Devices. 13 (5), 423-433 (2016).
- Naiman, M., Markota, A., Hegazy, A. F., Dingley, J., Kulstad, E. Temperature Management in Critical Care and Burn Patients using an Esophageal Heat Transfer Device. Military Medicine. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Althenayan, E. Temperature control in critically ill patients with a novel esophageal cooling device: a case series. BMC Anesthesiol. 15, 152 (2015).
- Bukovnik, N., Markota, A., Velnar, T., Rebol, J., Sinkovic, A. Therapeutic hypothermia and inhalation anesthesia in a patient with severe pneumococcal meningitis and secondary cardiac arrest. Am J Emerg Med. 35 (4), 665.e665-665.e666 (2017).
- Markota, A., Fluher, J., Kit, B., Balazic, P., Sinkovic, A. The introduction of an esophageal heat transfer device into a therapeutic hypothermia protocol: A prospective evaluation. Am J Emerg Med. 34 (4), 741-745 (2016).
- Markota, A., Kit, B., Fluher, J., Sinkovic, A. Use of an oesophageal heat transfer device in therapeutic hypothermia. Resuscitation. 89, e1-e2 (2015).
- Schroeder, D. C., et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management. PLoS One. 12 (3), e0173229 (2017).
- Williams, D., et al. Use of an Esophageal Heat Exchanger to Maintain Core Temperature during Burn Excisions and to Attenuate Pyrexia on the Burns Intensive Care Unit. Case Reports in Anesthesiology. 2016, 6 (2016).
- Khan, I., et al. . 14th Annual Neurocritical Care Society Meeting. , (2016).
- HACA. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 346 (8), 549-556 (2002).
- Bernard, S. A., et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 346 (8), 557-563 (2002).
- Callaway, C. W., et al. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S465-S482 (2015).
- Wyckoff, M. H., et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S543-S560 (2015).
- Niemann, C. U., et al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 373 (5), 405-414 (2015).
- Schortgen, F., et al. Fever control using external cooling in septic shock: a randomized controlled trial. Am J Respir Crit Care Med. 185 (10), 1088-1095 (2012).
- Reccius, A., Mercado, P., Vargas, P., Canals, C., Montes, J. Inferior Vena Cava Thrombosis Related to Hypothermia Catheter: Report of 20 Consecutive Cases. Neurocrit Care. 23 (1), 72-77 (2015).
- Maze, R., et al. Endovascular cooling catheter related thrombosis in patients undergoing therapeutic hypothermia for out of hospital cardiac arrest. Resuscitation. 85 (10), 1354-1358 (2014).
- Simosa, H. F., Petersen, D. J., Agarwal, S. K., Burke, P. A., Hirsch, E. F. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg. 73 (5), 461-464 (2007).
- Kulstad, E., et al. Induction, maintenance, and reversal of therapeutic hypothermia with an esophageal heat transfer device. Resuscitation. 84 (11), 1619-1624 (2013).
- van Zanten, A. R., Polderman, K. H. Blowing hot and cold? Skin counter warming to prevent shivering during therapeutic cooling. Crit Care Med. 37 (6), 2106-2108 (2009).
- Tommasi, E., et al. Cooling techniques in mild hypothermia after cardiac arrest. J Cardiovasc Med. , (2014).
- Diringer, M. N. Treatment of fever in the neurologic intensive care unit with a catheter-based heat exchange system. Crit Care Med. 32 (2), 559-564 (2004).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. 46 (3), 143-148 (2017).

