患者体温コントロールと対象となる温度管理の食道の熱伝達
Summary
本研究は、冷却または患者を地球温暖化の効果的な患者の温度管理を提供する手法を示します。シングルユース、トリプル ルーメン デバイスは標準 orogastric チューブに似ています、食道に入れるし、自動の患者の体温管理を実行する既存の熱交換ユニットに接続します。
Abstract
患者の温度を制御するさまざまな病態が重要です。虚 (出血性脳卒中、くも膜下出血、心不全、またはその他の低酸素の傷害) 後神経保護のためしばしば実行は正常以下に正常な体温を冷却します。発熱状態から冷却熱を扱い、傷つけられたニューロンに温熱療法の負の影響を低減します。患者は、増加血液の損失、創傷感染、また回復時間を延長中の心筋傷害を引き起こす知られている不注意による周術期の低体温を防ぐために手術室で暖めています。温度管理、転用標準供給 (例えば氷、冷たい生理食塩水、ファン、毛布) が、温度管理用に設計されたより高度な技術は、即興のメソッドを含む多くの報告されたアプローチがあります。通常より最適化されたプロトコルを提供することに成功しました。最後の 10 年間、高度な技術は 2 つの熱転送方法を開発している: デバイスの表面 (毛布、強制空気ウォーマー水) または血管内デバイス (滅菌カテーテル血管の配置を必要とする)。最近では、新しいデバイスの利用可能になったが患者のコアを介して効率的な熱伝達を提供する標準 orogastric チューブに似ています、食道に配置。既存の熱交換ユニット標準温度センサーから温度を患者を用いたサーボ機構による自動患者温度管理を可能にする接続デバイス (直腸、フォーリー、または他のコア温度センサーなど) 入力変数として。この方法は血管の配置合併症 (深部静脈血栓症、中央線関連血流感染症) を排除、患者のアクセスを妨害を削減し、表面のアプローチと比較して、少ない震えを引き起こします。パブリッシュされたデータは、精度の高度と温度管理に食道のアプローチを使用してターゲット温度の維持にも示されています。したがって、このメソッドの目的は、救急医療における制御の患者体温の危険性の低い代替方法を提供します。
Introduction
心停止、難治性や再発性の発熱、神経因性の発熱、大手術など、条件の広い範囲の治療患者体温管理の重要な必要性があります。アメリカ合衆国で 50万心臓逮捕毎年発信1 (たとえば、一般的な医療や外科手術の条件のためのケアを受けている患者) の病院または病院から (たとえば、自宅や公共の場で救急外来に来たが、)2。両方のシナリオでアクティブな温度管理で、投与3ターゲット温度管理 (TTM) 心不全の標準 2005 年以来大幅に患者の転帰が改善します。以上 500 万患者は年間の米国4集中治療室に認めています。非神経学的負傷した患者5の 45% までに発症する発熱、これらの神経学的損傷患者6割まで。集中治療室における熱制御は、高温代謝要求が増加、脳虚血を悪化させるし、増加する神経細胞の損失7改良の成果と、死の危険性が低減に関連付けられます。米国で毎年少なくとも 1000 万手術は、不注意による周術期体温8を防ぐためにアクティブな患者の温暖化を必要とします。手術室で手術を受ける患者は多数の副作用を避けるために 36 ° C を超える体温を維持しなければなりません。前に、中、または手術増加血損失、感染症、および病院長滞在は、$7,000 を追加または入院費9,10,11 患者 1 人あたりより後体温で予期しない減少 ,12。
偉大な臨床の必要性にもかかわらず最も広く投与温度管理プロトコルは不十分な性能を発揮または患者に重大なリスクを紹介します。表面のデバイス (水毛布、伝導マットレスや強制換気カバー) など面倒です、熱伝達能力が限られている、患者のケアおよびプロシージャの患者へのアクセスを許可するように削除する必要があります。侵襲的な血管内デバイスは、置き、感染症や血液凝固に患者をし向けることは困難。不注意による周術期の低体温を防ぐために既存のアプローチは常温療法時間12,13,14,,1516とのレトロスペクティブ分析の最大 70% を維持するために失敗します。後心臓逮捕の冷却、全体的に見て、6 h17内目標温度に達するに失敗した患者の 30% を発見しました。
食道患者の温度管理方法では、既存の技術18への相当な利点を提供しています。食道の温度管理装置は、救命救急や手術患者集団通常胃チューブの機能を維持します。連続胃吸引と食道 (図 1) の良好な熱 exchange 環境を活用することにより安全かつ効率的に患者の体温をコントロールする機能を追加しながらガスと液体の減圧をことができます。温度変調を実現するには、いくつか外部熱交換器 (冷凍機とも呼ばれる) 冷却剤として水を使用するのいずれかに食道の温度管理デバイスを接続します。いくつかのベンダーは、(最も頻繁に水毛布) 既存の温度制御製品を駆動するための病院で利用できる互換性の熱交換機を生産します。食道温管理デバイス、通常配置看護師、看護師医師、または医師が、標準的な orogastric チューブを配置する訓練を受けて、プロバイダーによって挿入することも。食道の温度管理装置患者へのアクセスを制限されていません、滅菌する必要はありません、プロバイダー間針棒の傷害のリスクを回避、患者の血栓や血流感染症、皮膚の合併症のリスクを回避できます。したがって、このメソッドの目的は、患者ケアと手術室の重要な設定温度を制御するための低リスクの代替方法を提供します。
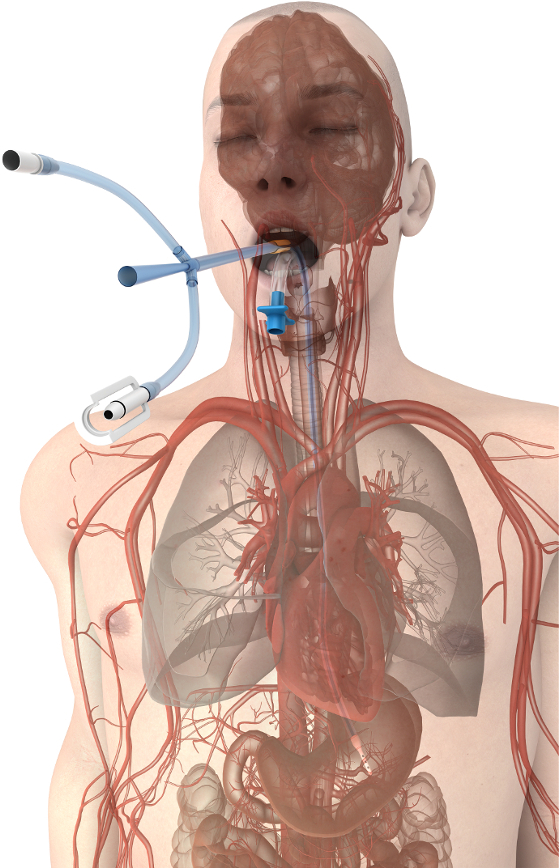
図 1。食道の温度管理機器配置します。大血管や心臓にデバイスの近さは、患者のコアで効率的な熱伝達を促進します。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
変更とトラブルシューティングこのプロトコルに必要な一般的に限られ、上記の特色を医療救急医療における採用の典型的な監視が含まれます。コアの温度を調節することは、臨床シナリオの成長範囲で患者の転帰に不可欠です。常温療法、不注意による、または意図的な低体温症から加温から低体温症の意図的な誘導などが偶発的な低体温症の条件の間に正常な体温 (すなわち、常温療法) を積極的に図り、は、一般的な手術室。具体的な臨床例、虚血再灌流障害に苦しむ、心停止時に発生するよう患者に対して 3 つまでの穏やかな加温、発熱防止に続いて (一般的に正常な体温以下の温度) 冷却すると便利します。後蘇生28,29,30日。新生児低酸素性虚血性脳症に苦しんでは、通常の身体温度31以下に冷却される場合に改善の結果を取得します。腎移植ドナーの臓器移植の前に、神経の死の後の冷却遅延移植関数32の率を減らすために示されています。敗血症性ショック患者の発熱を制御する昇圧要件を軽減し、早期の死亡率33の削減に貢献。滞在日数を短縮し、死10の可能性を削減しながら手術創感染、心筋合併症、出血量と輸血量を減らす常温療法外科手術を受ける患者を維持します。,11,16。
技術の制限、救急患者の管理で発生した課題があります。最も一般的な温度変調技術が患者とプロバイダー (配置、血流感染症、血液凝固障害を含む物流課題にリスクを紹介中の体温管理目標は、良好な結果を促進し、肌のダメージと費用)。食道の温度管理は、これらの欠点34,35,36を克服するために設計されています。適切に管理されている場合食道の温度管理装置当たらない血管 (血管内温度変調デバイスを行う)、または皮膚 (ように表面温度変調デバイス) を回避するため血液凝固、血流感染症、皮膚の劣化。デバイスは、さまざまな分21,37の問題で通常の医療プロバイダーによってすばやく配置できます。挿入法は、標準的な orogastric チューブは、治療開始が遅くなる可能性ワークフローの中断を最小限に抑えるを模倣します。コアのアプローチを使用して表面に近づく27,38,,3940よりも著しく小さい震えの負担をもたらすことも表示されます。鎮静剤を減らすことの利点があり、反震え薬、コストし、患者の鎮静の必要度が低くから早く覚醒経由での滞在日数が短くなります。コンサートで、上記臨床性能を考慮したこれらの機能は、救急部、集中治療部、手術室でプロバイダーの実行可能な選択肢として食道温管理をサポートします。デバイスに公表されたデータ ・ セットには、この新しいアプローチ21,22,23,24,27,41同様にサポートしています。
プロトコルの中で重要なステップは、簡単に配置、胃吸引・減圧の間最大の接触を許可するを実行することを保証するために、デバイスに十分な潤滑油を提供する挿入前にデバイス内のフローを開始します。デバイスおよび患者と震えている患者に対処を開発可能性があります。このプロトコルを次は最適な結果を提供し、この重要な患者のケアに高度なパフォーマンスと安全性を許可します。
Disclosures
The authors have nothing to disclose.
Acknowledgements
なし。
Materials
| EnsoETM | Attune Medical | ECD01 | Device compatible with Gaymar/Stryker Medi-Therm III and Stryker Altrix Precision Temperature Management System |
| EnsoETM | Attune Medical | ECD02 | Device compatible with Cincinnati SubZero Blanketrol II and Cincinnati SubZero Blanketrol III |
| Gaymar/Stryker Medi-Therm III | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Cincinnati SubZero Blanketrol II | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Cincinnati SubZero Blanketrol III | Gentherm | n/a | Compatible heater-cooler with the ECD02 |
| Stryker Altrix Precision Temperature Management System | Stryker | n/a | Compatible heater-cooler with the ECD01 |
| Water-soluble lubricant | Various | n/a | Standard water-soluble lubricant used to ease insertion of tubes, catheters, and digits |
| Securement device | Various | n/a | E.g., Guard360 by PrimeGuard Medical |
References
- Chan, P. S., Krumholz, H. M., Nichol, G., Nallamothu, B. K. Delayed time to defibrillation after in-hospital cardiac arrest. N Engl J Med. 358 (1), 9-17 (2008).
- Callans, D. J. Out-of-Hospital Cardiac Arrest — The Solution Is Shocking. N Engl J Med. 351 (7), 632-634 (2004).
- Kochanek, P. M., Jackson, T. C. The Brain and Hypothermia-From Aristotle to Targeted Temperature Management. Crit Care Med. 45 (2), 305-310 (2017).
- Laupland, K. B., et al. Occurrence and outcome of fever in critically ill adults. Crit Care Med. 36 (5), 1531-1535 (2008).
- Diringer, M. N., Reaven, N. L., Funk, S. E., Uman, G. C. Elevated body temperature independently contributes to increased length of stay in neurologic intensive care unit patients. Critical Care Medicine. 32 (7), 1489-1495 (2004).
- Laupland, K. B. Fever in the critically ill medical patient. Critical care medicine. 37 (Suppl 7), S273-S278 (2009).
- Mathias, J. M. Hospitals to report on normothermia. OR manager. 25 (9), 22-24 (2009).
- Rajagopalan, S., Mascha, E., Na, J., Sessler, D. I. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 108 (1), 71-77 (2008).
- Kurz, A., Sessler, D. I., Lenhardt, R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med. 334 (19), 1209-1215 (1996).
- Sessler, D. I. New surgical thermal management guidelines. Lancet. 374 (9695), 1049-1050 (2009).
- Young, V. L., Watson, M. E. Prevention of perioperative hypothermia in plastic surgery. Aesthet Surg J. 26 (5), 551-571 (2006).
- Hedrick, T. L., et al. Efficacy of protocol implementation on incidence of wound infection in colorectal operations. J Am Coll Surg. 205 (3), 432-438 (2007).
- Forbes, S. S., et al. Implementation of evidence-based practices for surgical site infection prophylaxis: results of a pre- and postintervention study. J Am Coll Surg. 207 (3), 336-341 (2008).
- Sun, Z., et al. Intraoperative core temperature patterns, transfusion requirement, and hospital duration in patients warmed with forced air. Anesthesiology. 122 (2), 276-285 (2015).
- Leary, M., et al. The association of body mass index with time to target temperature and outcomes following post-arrest targeted temperature management. Resuscitation. 85 (2), 244-247 (2014).
- Naiman, M., Shanley, P., Garrett, F., Kulstad, E. Evaluation of advanced cooling therapy’s esophageal cooling device for core temperature control. Expert Rev Med Devices. 13 (5), 423-433 (2016).
- Naiman, M., Markota, A., Hegazy, A. F., Dingley, J., Kulstad, E. Temperature Management in Critical Care and Burn Patients using an Esophageal Heat Transfer Device. Military Medicine. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. , (2017).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Althenayan, E. Temperature control in critically ill patients with a novel esophageal cooling device: a case series. BMC Anesthesiol. 15, 152 (2015).
- Bukovnik, N., Markota, A., Velnar, T., Rebol, J., Sinkovic, A. Therapeutic hypothermia and inhalation anesthesia in a patient with severe pneumococcal meningitis and secondary cardiac arrest. Am J Emerg Med. 35 (4), 665.e665-665.e666 (2017).
- Markota, A., Fluher, J., Kit, B., Balazic, P., Sinkovic, A. The introduction of an esophageal heat transfer device into a therapeutic hypothermia protocol: A prospective evaluation. Am J Emerg Med. 34 (4), 741-745 (2016).
- Markota, A., Kit, B., Fluher, J., Sinkovic, A. Use of an oesophageal heat transfer device in therapeutic hypothermia. Resuscitation. 89, e1-e2 (2015).
- Schroeder, D. C., et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management. PLoS One. 12 (3), e0173229 (2017).
- Williams, D., et al. Use of an Esophageal Heat Exchanger to Maintain Core Temperature during Burn Excisions and to Attenuate Pyrexia on the Burns Intensive Care Unit. Case Reports in Anesthesiology. 2016, 6 (2016).
- Khan, I., et al. . 14th Annual Neurocritical Care Society Meeting. , (2016).
- HACA. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 346 (8), 549-556 (2002).
- Bernard, S. A., et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 346 (8), 557-563 (2002).
- Callaway, C. W., et al. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S465-S482 (2015).
- Wyckoff, M. H., et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 132 (18 Suppl 2), S543-S560 (2015).
- Niemann, C. U., et al. Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 373 (5), 405-414 (2015).
- Schortgen, F., et al. Fever control using external cooling in septic shock: a randomized controlled trial. Am J Respir Crit Care Med. 185 (10), 1088-1095 (2012).
- Reccius, A., Mercado, P., Vargas, P., Canals, C., Montes, J. Inferior Vena Cava Thrombosis Related to Hypothermia Catheter: Report of 20 Consecutive Cases. Neurocrit Care. 23 (1), 72-77 (2015).
- Maze, R., et al. Endovascular cooling catheter related thrombosis in patients undergoing therapeutic hypothermia for out of hospital cardiac arrest. Resuscitation. 85 (10), 1354-1358 (2014).
- Simosa, H. F., Petersen, D. J., Agarwal, S. K., Burke, P. A., Hirsch, E. F. Increased risk of deep venous thrombosis with endovascular cooling in patients with traumatic head injury. Am Surg. 73 (5), 461-464 (2007).
- Kulstad, E., et al. Induction, maintenance, and reversal of therapeutic hypothermia with an esophageal heat transfer device. Resuscitation. 84 (11), 1619-1624 (2013).
- van Zanten, A. R., Polderman, K. H. Blowing hot and cold? Skin counter warming to prevent shivering during therapeutic cooling. Crit Care Med. 37 (6), 2106-2108 (2009).
- Tommasi, E., et al. Cooling techniques in mild hypothermia after cardiac arrest. J Cardiovasc Med. , (2014).
- Diringer, M. N. Treatment of fever in the neurologic intensive care unit with a catheter-based heat exchange system. Crit Care Med. 32 (2), 559-564 (2004).
- Hegazy, A. F., Lapierre, D. M., Butler, R., Martin, J., Althenayan, E. The esophageal cooling device: A new temperature control tool in the intensivist’s arsenal. Heart Lung. 46 (3), 143-148 (2017).

