干式大孔海藻酸盐支架的制备和使用用于T细胞的病毒转导
Summary
本文是用于创建干燥的大孔藻酸盐支架的方案,该支架介导有效的病毒基因转移,用于T细胞的基因工程,包括用于CAR-T细胞治疗的T细胞。支架被证明以>85%的转导转导活化的原代T细胞。
Abstract
在过去几年中,用于CAR-T细胞治疗的T细胞基因工程已成为癌症治疗的最前沿。CAR-T细胞是通过病毒基因转移到T细胞中产生的。目前病毒基因转移的黄金标准涉及再连蛋白包被板的棘刺,这既昂贵又耗时。非常需要高效且具有成本效益的方法来生成CAR-T细胞。这里描述的是一种制造廉价、干燥的大孔海藻酸盐支架的方法,称为 Drydux 支架,可有效促进活化 T 细胞的病毒转导。支架设计用于代替接种病毒的再连蛋白包被板的金标准棘刺,并简化转导细胞的过程。海藻酸盐与钙-D-葡萄糖酸盐交联并冷冻过夜以产生支架。将冷冻支架在冻干机中冷冻干燥72小时,以完成干燥的大孔支架的形成。当病毒和活化的T细胞一起接种在支架顶部以产生转基因细胞时,支架介导病毒基因转移。支架产生>85%的原代T细胞转导,这与棘皮膜在Retronectin包被的板上的转导效率相当。这些结果表明,干式大孔海藻酸盐支架是传统转导方法的更便宜、更方便的替代方案。
Introduction
免疫疗法已成为一种革命性的癌症治疗范例,因为它能够特异性靶向肿瘤、限制脱靶细胞毒性和预防复发。特别是嵌合抗原受体T(CAR-T)细胞疗法因其在治疗淋巴瘤和白血病方面的成功而广受欢迎。FDA于2017年批准了第一种CAR-T细胞疗法,此后又批准了四种CAR-T细胞疗法1,2,3,4,5。CAR 具有抗原识别结构域,通常由单克隆抗体的单链可变片段组成,该片段对肿瘤相关抗原3,4 具有特异性。当CAR与其肿瘤相关抗原相互作用时,CAR-T细胞被激活,导致涉及细胞因子释放,细胞溶解脱颗粒,转录因子表达和T细胞增殖的抗肿瘤反应。为了产生CAR-T细胞,从患者身上收集血液以获得他们的T细胞。CAR是使用病毒遗传添加到患者的T细胞中的。CAR-T细胞在体外生长并输回患者体内2,3,4,6。CAR-T细胞的成功生成取决于转导效率,转导效率描述了转基因成CAR-T细胞的T细胞数量。
目前,CAR-T细胞生成的金标准是活化的T细胞和病毒在再连蛋白包被的平板7,8上的棘化。当病毒颗粒与T细胞表面接触时,转导开始。Retronectin通过增加病毒颗粒和细胞之间的结合效率来促进病毒和细胞的共定位,增强转导7,8。Retronectin本身不能很好地工作,需要伴随着脊髓,这通过浓缩病毒颗粒和增加T细胞的表面通透性来增强基因转移,从而使病毒感染更容易8。尽管在 retronectin 包被的板上成功了脊髓成形,但这是一个复杂的过程,需要多次旋转循环和昂贵的试剂。因此,非常需要更快、更便宜的病毒基因转移替代方法。
海藻酸盐是一种天然阴离子多糖,由于其成本低、安全性好以及与二价阳离子9,10,11,12 混合后形成水凝胶的能力,广泛用于生物医学行业。海藻酸盐是一种符合 GMP 标准的聚合物,通常被 FDA13 认可为安全 (GRAS)。海藻酸盐与阳离子交联产生稳定的水凝胶,通常用于伤口愈合,小化学药物和蛋白质的递送以及细胞运输9,10,11,12,14,15,16。由于其优异的胶凝性能,海藻酸盐是通过冷冻干燥制造多孔支架的首选材料10,17。藻酸盐的这些特性使其成为生产可以介导活化细胞病毒基因转移的支架的有吸引力的候选者。
这里描述的是用于制造干大孔藻酸盐支架的方案,称为 Drydux 支架,其通过病毒基因转移静态转导 T 细胞17,18。制作这些支架的过程如图 1所示。这些支架消除了对再连接蛋白涂层板的棘刺形成的需要。大孔藻酸盐支架促进病毒颗粒和T细胞的相互作用,从而在一步中实现高效的基因转移,而不会影响工程T细胞的功能和活力17。如果正确遵循,这些大孔藻酸盐支架的转导效率至少为80%,简化和缩短了病毒转导过程。
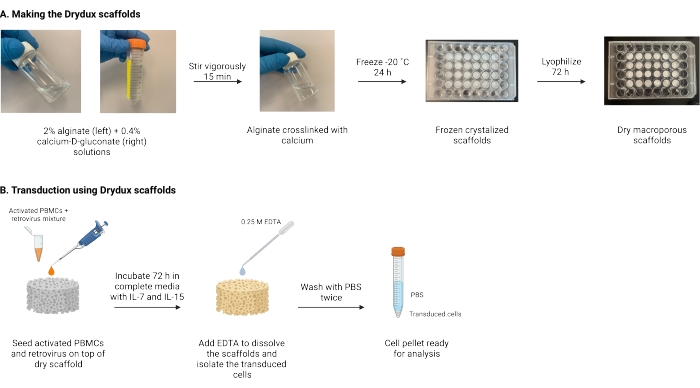
图 1:协议的示意图和 时间表。 (A)制作干式大孔海藻酸盐支架的时间表。海藻酸盐与钙-D-葡萄糖酸交联并冷冻过夜。将冷冻支架冻干72小时以创建Drydux支架。(B)活化细胞病毒转导的时间表。将活化的细胞和病毒(MOI 2)接种在支架顶部,并在补充有IL-7和IL-15的完整培养基中孵育。支架吸收混合物并促进病毒基因转移。EDTA用于溶解支架并分离转导细胞。用PBS洗涤两次后,细胞沉淀可用于分析。缩写:PBS = 磷酸盐缓冲盐水;PBMC=外周血单核细胞。 请点击此处查看此图的大图。
Protocol
Representative Results
Discussion
CAR-T细胞疗法继续引起人们对研究和商业应用的兴趣。尽管CAR-T细胞疗法在治疗血癌方面取得了成功,但该程序的高成本限制了其使用。这里介绍的方案介绍了一种用于T细胞病毒基因转移的新方法,而无需对retronectin包被的板进行棘刺。生产干燥的大孔海藻酸盐支架来介导转导相对简单,是传统方法的合适低成本替代品。
有时,支架外观可能与图2所示不…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作得到了美国国立卫生研究院通过拨款编号R37-CA260223,R21CA246414的支持。我们感谢NCSU流式细胞术核心对流式细胞术分析的培训和指导。原理图是用 Biorender.com 创建的
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

