Fabricación y uso de andamios secos de alginato macroporoso para la transducción viral de células T
Summary
Aquí hay un protocolo para crear andamios de alginato macroporoso seco que median la transferencia eficiente de genes virales para su uso en ingeniería genética de células T, incluidas las células T para la terapia de células CAR-T. Se demostró que los andamios transducen células T primarias activadas con una transducción del >85%.
Abstract
La ingeniería genética de las células T para la terapia de células CAR-T ha llegado a la vanguardia del tratamiento del cáncer en los últimos años. Las células CAR-T se producen por transferencia de genes virales a células T. El estándar de oro actual de la transferencia de genes virales implica la espinoculación de placas recubiertas de retronectina, que es costosa y requiere mucho tiempo. Existe una necesidad significativa de métodos eficientes y rentables para generar células CAR-T. Aquí se describe un método para fabricar andamios de alginato macroporoso secos y de bajo costo, conocidos como andamios Drydux, que promueven eficientemente la transducción viral de células T activadas. Los andamios están diseñados para ser utilizados en lugar de la espinoculación estándar de oro de placas recubiertas de retronectina sembradas con virus y simplificar el proceso de transducción de células. El alginato se reticula con el D-gluconato de calcio y se congela durante la noche para crear los andamios. Los andamios congelados se liofilizan en un liofilizador durante 72 h para completar la formación de los andamios macroporosos secos. Los andamios median la transferencia de genes virales cuando el virus y las células T activadas se siembran juntas en la parte superior del andamio para producir células modificadas genéticamente. Los andamios producen >85% de transducción primaria de células T, que es comparable a la eficiencia de transducción de la espinoculación en placas recubiertas de retronectina. Estos resultados demuestran que los andamios secos de alginato macroporoso sirven como una alternativa más barata y conveniente al método de transducción convencional.
Introduction
La inmunoterapia se ha convertido en un paradigma revolucionario de tratamiento del cáncer debido a su capacidad para atacar específicamente los tumores, limitar la citotoxicidad fuera del objetivo y prevenir la recaída. En particular, la terapia celular con receptor de antígeno quimérico T (CAR-T) ha ganado popularidad debido a su éxito en el tratamiento de linfomas y leucemias. La FDA aprobó la primera terapia de células CAR-T en 2017 y, desde entonces, ha aprobado cuatro terapias más de células CAR-T 1,2,3,4,5. Los CAR tienen un dominio de reconocimiento de antígenos que generalmente consiste en un fragmento variable de cadena única de un anticuerpo monoclonal que es específico para un antígeno asociado al tumor 3,4. Cuando un CAR interactúa con su antígeno asociado al tumor, las células CAR-T se activan, lo que lleva a una respuesta antitumoral que implica la liberación de citoquinas, la desgranulación citolítica, la expresión del factor de transcripción y la proliferación de células T. Para producir células CAR-T, se recoge sangre del paciente para obtener sus células T. Los CAR se agregan genéticamente a las células T del paciente utilizando un virus. Las células CAR-T se cultivan in vitro y se infunden de nuevo en el paciente 2,3,4,6. La generación exitosa de células CAR-T está determinada por la eficiencia de transducción, que describe el número de células T que se modifican genéticamente en células CAR-T.
Actualmente, el estándar de oro para la generación de células CAR-T es la espinoculación de células T activadas y virus en placas recubiertas de retronectina 7,8. La transducción comienza cuando las partículas virales se involucran con la superficie de las células T. La retronectina promueve la colocalización de virus y células aumentando la eficiencia de unión entre las partículas virales y las células, mejorando la transducción 7,8. La retronectina no funciona bien por sí sola y necesita ir acompañada de espinoculación, lo que mejora la transferencia de genes al concentrar las partículas virales y aumentar la permeabilidad superficial de la célula T, lo que permite una infección viral más fácil8. A pesar del éxito de la espinoculación en placas recubiertas de retronectina, es un proceso complejo que requiere múltiples ciclos de centrifugado y reactivos costosos. Por lo tanto, los métodos alternativos para la transferencia de genes virales que son más rápidos y más baratos son altamente deseables.
El alginato es un polisacárido aniónico natural ampliamente utilizado en la industria biomédica debido a su bajo costo, buen perfil de seguridad y capacidad para formar hidrogeles al mezclarse con cationes divalentes 9,10,11,12. El alginato es un polímero que cumple con GMP y generalmente es reconocido como seguro (GRAS) por la FDA13. La reticulación del alginato con cationes crea hidrogeles estables que a menudo se usan en la cicatrización de heridas, la administración de pequeños fármacos químicos y proteínas, y el transporte celular 9,10,11,12,14,15,16. Debido a sus excelentes propiedades gelificantes, el alginato es el material preferido para crear andamios porosos por liofilización10,17. Estas características del alginato lo convierten en un candidato atractivo para producir un andamio que puede mediar la transferencia de genes virales de las células activadas.
Aquí se describe un protocolo para hacer andamios secos de alginato macroporoso, conocidos como andamios Drydux, que transducen estáticamente células T por transferencia de genes virales17,18. El proceso para hacer estos andamios se muestra en la Figura 1. Estos andamios eliminan la necesidad de espinoculación de las placas recubiertas de retronectina. Los andamios de alginato macroporoso estimulan la interacción de partículas virales y células T para permitir la transferencia eficiente de genes en un solo paso sin afectar la funcionalidad y viabilidad de las células T diseñadas17. Cuando se siguen correctamente, estos andamios de alginato macroporoso tienen una eficiencia de transducción de al menos el 80%, simplificando y acortando el proceso de transducción viral.
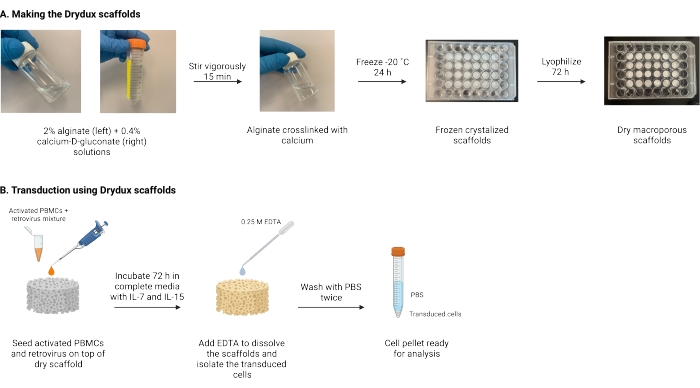
Figura 1: Esquema y cronología del protocolo . (A) Cronología para la fabricación de los andamios secos de alginato macroporoso. El alginato se reticula con el D-gluconato de calcio y se congela durante la noche. Los andamios congelados se liofilizan durante 72 h para crear los andamios Drydux. (B) Cronología para la transducción viral de células activadas. Las células activadas y el virus (MOI 2) se siembran en la parte superior del andamio y se incuban en medios completos suplementados con IL-7 e IL-15. Los andamios absorben la mezcla y promueven la transferencia de genes virales. El EDTA se utiliza para disolver los andamios y aislar las células transducidas. Después de lavar dos veces con PBS, el pellet celular se puede utilizar para el análisis. Abreviaturas: PBS = solución salina tamponada con fosfato; PBMCs = células mononucleares de sangre periférica. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La terapia de células CAR-T continúa ganando interés tanto para la investigación como para las aplicaciones comerciales. A pesar del éxito que la terapia de células CAR-T ha tenido en el tratamiento de cánceres de sangre, el alto costo del procedimiento limita su uso. El protocolo presentado aquí introduce un nuevo método para la transferencia de genes virales de células T sin la necesidad de espinoculación de placas recubiertas de retronectina. La producción de andamios secos de alginato macroporoso para med…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por los Institutos Nacionales de Salud a través de los números de subvención R37-CA260223, R21CA246414. Agradecemos al núcleo de citometría de flujo de NCSU por su capacitación y orientación sobre el análisis de citometría de flujo. Los esquemas se crearon con Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

