Fabricação e Uso de Andaimes Secos de Alginato Macroporoso para Transdução Viral de Células T
Summary
Aqui está um protocolo para a criação de andaimes de alginato macroporoso secos que medeiam a transferência eficiente de genes virais para uso em engenharia genética de células T, incluindo células T para terapia com células CAR-T. Os andaimes demonstraram transduzir células T primárias ativadas com transdução de >85%.
Abstract
A engenharia genética de células T para terapia com células CAR-T chegou à vanguarda do tratamento do câncer nos últimos anos. As células CAR-T são produzidas pela transferência de genes virais para as células T. O atual padrão-ouro de transferência de genes virais envolve a espinoculação de placas revestidas de retronectina, o que é caro e demorado. Há uma necessidade significativa de métodos eficientes e econômicos para gerar células CAR-T. Descrito aqui é um método para a fabricação de andaimes de alginato macroporosos secos e baratos, conhecidos como andaimes Drydux, que promovem eficientemente a transdução viral de células T ativadas. Os andaimes são projetados para serem usados no lugar da espinoculação padrão-ouro de placas revestidas de retronectina semeadas com vírus e simplificam o processo de transdução de células. O alginato é reticulado com cálcio-D-gluconato e congelado durante a noite para criar os andaimes. Os andaimes congelados são liofilizados em um liofilizador por 72 h para completar a formação dos andaimes macroporosos secos. Os andaimes mediam a transferência de genes virais quando o vírus e as células T ativadas são semeados juntos no topo do andaime para produzir células geneticamente modificadas. Os andaimes produzem >85% de transdução primária de células T, o que é comparável à eficiência de transdução da espinoculação em placas revestidas de retronectina. Estes resultados demonstram que os andaimes de alginato macroporoso secos servem como uma alternativa mais barata e conveniente ao método de transdução convencional.
Introduction
A imunoterapia emergiu como um paradigma revolucionário de tratamento do câncer devido à sua capacidade de atingir especificamente tumores, limitar a citotoxicidade fora do alvo e prevenir a recaída. Particularmente, a terapia celular com receptor de antígeno quimérico T (CAR-T) ganhou popularidade devido ao seu sucesso no tratamento de linfomas e leucemias. A FDA aprovou a primeira terapia com células CAR-T em 2017 e, desde então, aprovou mais quatro terapias com células CAR-T 1,2,3,4,5. Os CARs têm um domínio de reconhecimento de antígeno geralmente consistindo de um fragmento variável de cadeia única de um anticorpo monoclonal que é específico para um antígeno associado ao tumor 3,4. Quando um CAR interage com seu antígeno associado ao tumor, as células CAR-T são ativadas, levando a uma resposta antitumoral envolvendo liberação de citocinas, degranulação citolítica, expressão do fator de transcrição e proliferação de células T. Para produzir células CAR-T, o sangue é coletado do paciente para obter suas células T. Os CARs são geneticamente adicionados às células T do paciente usando um vírus. As células CAR-T são cultivadas in vitro e infundidas de volta no paciente 2,3,4,6. A geração bem-sucedida de células CAR-T é determinada pela eficiência de transdução, que descreve o número de células T que são geneticamente modificadas em células CAR-T.
Atualmente, o padrão-ouro para a geração de células CAR-T é a espinoculação de células T ativadas e vírus em placas revestidas de retronectina 7,8. A transdução começa quando as partículas virais se envolvem com a superfície das células T. A retronectina promove a colocalização de vírus e células, aumentando a eficiência de ligação entre as partículas virais e as células, aumentando a transdução 7,8. A retronectina não funciona bem por si só e precisa ser acompanhada de espinoculação, o que aumenta a transferência gênica, concentrando as partículas virais e aumentando a permeabilidade superficial da célula T, permitindo uma infecção viral mais fácil8. Apesar do sucesso da espinoculação em placas revestidas de retronectina, é um processo complexo que requer múltiplos ciclos de rotação e reagentes caros. Portanto, métodos alternativos para a transferência de genes virais que são mais rápidos e mais baratos são altamente desejáveis.
O alginato é um polissacarídeo aniônico natural amplamente utilizado na indústria biomédica devido ao seu baixo custo, bom perfil de segurança e capacidade de formar hidrogéis após a mistura com cátions divalentes 9,10,11,12. O alginato é um polímero compatível com GMP e é geralmente reconhecido como seguro (GRAS) pela FDA13. A reticulação do alginato com cátions cria hidrogéis estáveis frequentemente utilizados na cicatrização de feridas, na entrega de pequenas drogas químicas e proteínas e no transporte celular 9,10,11,12,14,15,16. Devido às suas excelentes propriedades gelificantes, o alginato é o material preferido para criar andaimes porosos por liofilização10,17. Essas características do alginato o tornam um candidato atraente para a produção de um andaime que pode mediar a transferência de genes virais de células ativadas.
Descreve-se aqui um protocolo para a confecção de andaimes de alginato macroporoso secos, conhecidos como andaimes de Drydux, que transduziram estaticamente células T por transferência de genes virais17,18. O processo de fabricação desses andaimes é mostrado na Figura 1. Esses andaimes eliminam a necessidade de espinoculação de placas revestidas de retronectina. Os andaimes de alginato macroporoso estimulam a interação de partículas virais e células T para permitir a transferência eficiente de genes em uma única etapa, sem afetar a funcionalidade e a viabilidade das células T modificadas17. Quando seguidos corretamente, esses andaimes de alginato macroporoso têm uma eficiência de transdução de pelo menos 80%, simplificando e encurtando o processo de transdução viral.
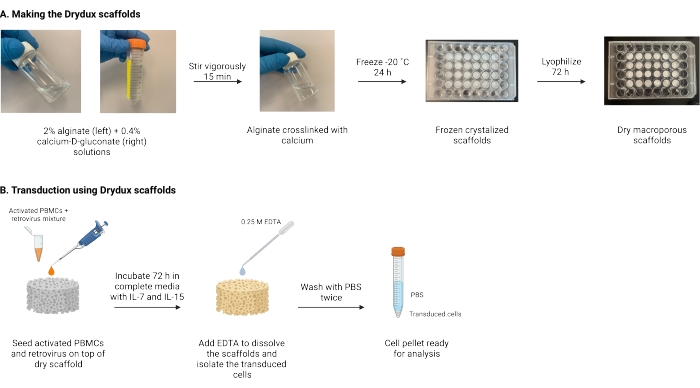
Figura 1: Esquema e linha do tempo do protocolo. (A) Linha do tempo para fazer os andaimes secos de alginato macroporoso. O alginato é reticulado com cálcio-D-gluconato e congelado durante a noite. Os andaimes congelados são liofilizados por 72 h para criar os andaimes Drydux. (B) Cronograma para transdução viral de células ativadas. As células ativadas e o vírus (MOI 2) são semeados no topo do andaime e incubados em meio completo suplementado com IL-7 e IL-15. Os andaimes absorvem a mistura e promovem a transferência de genes virais. O EDTA é usado para dissolver os andaimes e isolar as células transduzidas. Após a lavagem duas vezes com PBS, o pellet celular pode ser usado para análise. Abreviaturas: PBS = solução salina tamponada com fosfato; PBMCs = células mononucleares do sangue periférico. Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A terapia celular CAR-T continua a ganhar interesse tanto para pesquisas quanto para aplicações comerciais. Apesar do sucesso que a terapia com células CAR-T teve no tratamento de cânceres no sangue, o alto custo do procedimento limita seu uso. O protocolo aqui apresentado introduz um novo método para a transferência de genes virais de células T sem a necessidade de espinoculação de placas revestidas de retronectina. A produção de andaimes de alginato macroporoso secos para mediar a transdução é relativamen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pelos Institutos Nacionais de Saúde através dos Números de Concessão R37-CA260223, R21CA246414. Agradecemos ao núcleo de citometria de fluxo da NCSU pelo treinamento e orientação na análise da citometria de fluxo. Os esquemas foram criados com Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

