T Hücrelerinin Viral Transdüksiyonu için Kuru Makrogözenekli Aljinat İskelelerinin İmalatı ve Kullanımı
Summary
Burada, CAR-T hücre tedavisi için T hücreleri de dahil olmak üzere T hücrelerinin genetik mühendisliğinde kullanılmak üzere verimli viral gen transferine aracılık eden kuru makrogözenekli aljinat iskeleleri oluşturmak için bir protokol bulunmaktadır. İskelelerin aktive olmuş primer T hücrelerini %>85 transdüksiyonla transdüksiyon yaptığı gösterilmiştir.
Abstract
CAR-T hücre tedavisi için T hücrelerinin genetik mühendisliği, son birkaç yılda kanser tedavisinde ön plana çıkmıştır. CAR-T hücreleri, T hücrelerine viral gen transferi ile üretilir. Viral gen transferinin mevcut altın standardı, pahalı ve zaman alıcı olan retronektin kaplı plakaların spinokülasyonunu içerir. CAR-T hücreleri üretmek için verimli ve uygun maliyetli yöntemlere önemli bir ihtiyaç vardır. Burada açıklanan, aktif T hücrelerinin viral transdüksiyonunu etkili bir şekilde teşvik eden Drydux iskeleleri olarak bilinen ucuz, kuru makrogözenekli aljinat iskelelerinin üretilmesi için bir yöntemdir. İskeleler, virüsle tohumlanmış retronektin kaplı plakaların altın standart spinokülasyonu yerine kullanılmak üzere tasarlanmıştır ve hücrelerin dönüştürülmesi işlemini basitleştirir. Aljinat, kalsiyum-D-glukonat ile çapraz bağlanır ve iskeleleri oluşturmak için gece boyunca dondurulur. Dondurulmuş iskeleler, kuru makrogözenekli iskelelerin oluşumunu tamamlamak için 72 saat boyunca bir liyofilizatörde dondurularak kurutulur. İskeleler, virüs ve aktive olmuş T hücreleri, genetiği değiştirilmiş hücreler üretmek için iskelenin üzerine birlikte tohumlandığında viral gen transferine aracılık eder. İskeleler, retronektin kaplı plakalarda spinokülasyonun transdüksiyon verimliliği ile karşılaştırılabilir olan% >85 primer T hücre transdüksiyonu üretir. Bu sonuçlar, kuru makrogözenekli aljinat iskelelerinin geleneksel transdüksiyon yöntemine daha ucuz ve daha uygun bir alternatif olarak hizmet ettiğini göstermektedir.
Introduction
İmmünoterapi, tümörleri spesifik olarak hedefleme, hedef dışı sitotoksisiteyi sınırlama ve nüksetmeyi önleme kabiliyeti nedeniyle devrim niteliğinde bir kanser tedavisi paradigması olarak ortaya çıkmıştır. Özellikle kimerik antijen reseptörü T (CAR-T) hücre tedavisi, lenfoma ve lösemi tedavisindeki başarısı nedeniyle popülerlik kazanmıştır. FDA, 2017 yılında ilk CAR-T hücre tedavisini onayladı ve o zamandan beri dört CAR-T hücre terapisini daha onayladı 1,2,3,4,5. CAR’lar genellikle tümörle ilişkili bir antijen 3,4 için spesifik olan bir monoklonal antikorun tek zincirli değişken fragmanından oluşan bir antijen tanıma alanına sahiptir. Bir CAR, tümörle ilişkili antijeniyle etkileşime girdiğinde, CAR-T hücreleri aktive olur ve sitokin salınımı, sitolitik degranülasyon, transkripsiyon faktörü ekspresyonu ve T hücresi proliferasyonunu içeren bir antitümör yanıta yol açar. CAR-T hücrelerini üretmek için, T hücrelerini elde etmek için hastadan kan toplanır. CAR’lar genetik olarak bir virüs kullanılarak hastanın T hücrelerine eklenir. CAR-T hücreleri in vitro olarak büyütülürve hastaya 2,3,4,6 geri verilir. CAR-T hücrelerinin başarılı bir şekilde üretilmesi, genetik olarak CAR-T hücrelerine dönüştürülen T hücrelerinin sayısını tanımlayan iletim verimliliği ile belirlenir.
Şu anda, CAR-T hücre üretimi için altın standart, retronektin kaplı plakalar 7,8 üzerinde aktive edilmiş T hücrelerinin ve virüsün spinokülasyonudur. Transdüksiyon, viral parçacıklar T hücrelerinin yüzeyine girdiğinde başlar. Retronektin, viral parçacıklar ve hücreler arasındaki bağlanma verimliliğini artırarak virüs ve hücrelerin kolokalizasyonunu teşvik eder ve transdüksiyonu arttırır 7,8. Retronektin kendi başına iyi çalışmaz ve viral parçacıkları yoğunlaştırarak ve T hücresinin yüzey geçirgenliğini artırarak gen transferini artıran ve daha kolay viral enfeksiyona izin veren spinokülasyonun eşlik etmesi gerekir8. Retronektin kaplı plakalarda spinokülasyonun başarısına rağmen, çoklu spin döngüleri ve pahalı reaktifler gerektiren karmaşık bir işlemdir. Bu nedenle, viral gen transferi için daha hızlı ve daha ucuz olan alternatif yöntemler oldukça arzu edilir.
Aljinat, düşük maliyeti, iyi güvenlik profili ve iki değerli katyonlar 9,10,11,12 ile karıştırıldığında hidrojel oluşturma kabiliyeti nedeniyle biyomedikal endüstrisinde yaygın olarak kullanılan doğal bir anyonik polisakkarittir. Aljinat, GMP uyumlu bir polimerdir ve genellikle FDA13 tarafından güvenli (GRAS) olarak kabul edilir. Aljinatın katyonlarla çapraz bağlanması, yara iyileşmesinde, küçük kimyasal ilaçların ve proteinlerin verilmesinde ve hücre taşınmasında sıklıkla kullanılan stabil hidrojeller oluşturur 9,10,11,12,14,15,16. Mükemmel jelleşme özellikleri nedeniyle, aljinat10,17 dondurarak kurutularak gözenekli iskeleler oluşturmak için tercih edilen malzemedir. Aljinatın bu özellikleri, aktif hücrelerin viral gen transferine aracılık edebilecek bir iskele üretmek için çekici bir aday olmasını sağlar.
Burada tarif edilen, Drydux iskeleleri olarak bilinen kuru makrogözenekli aljinat iskeleleri yapmak için kullanılan ve T hücrelerini viral gen transferi ile statik olarak dönüştüren bir protokoldür17,18. Bu iskelelerin yapım süreci Şekil 1’de gösterilmiştir. Bu iskeleler, retronektin kaplı plakaların spinokülasyonu ihtiyacını ortadan kaldırır. Makrogözenekli aljinat iskeleleri, mühendislik ürünü T hücrelerinin işlevselliğini ve yaşayabilirliğini etkilemeden tek bir adımda verimli gen transferini sağlamak için viral parçacıkların ve T hücrelerinin etkileşimini teşvik eder17. Doğru takip edildiğinde, bu makrogözenekli aljinat iskeleleri en az% 80’lik bir transdüksiyon verimliliğine sahiptir ve viral iletim sürecini basitleştirir ve kısaltır.
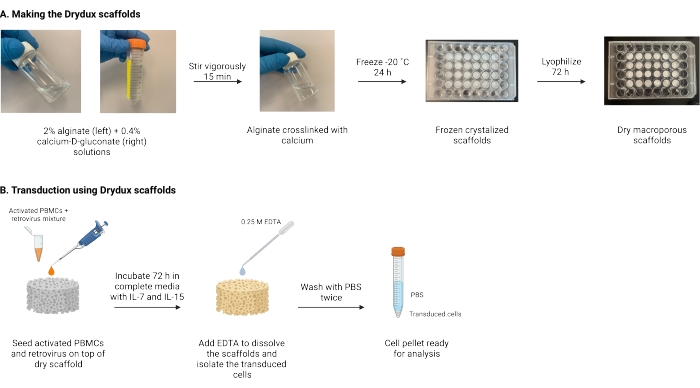
Şekil 1: Protokolün şeması ve zaman çizelgesi. (A) Kuru makrogözenekli aljinat iskelelerinin yapılması için zaman çizelgesi. Aljinat, kalsiyum-D-glukonat ile çapraz bağlanır ve gece boyunca dondurulur. Dondurulmuş iskeleler, Drydux iskelelerini oluşturmak için 72 saat boyunca liyofilize edilir. (B) Aktif hücrelerin viral transdüksiyonu için zaman çizelgesi. Aktif hücreler ve virüs (MOI 2) iskelenin üzerine ekilir ve IL-7 ve IL-15 ile desteklenmiş tam ortamda inkübe edilir. İskeleler karışımı emer ve viral gen transferini teşvik eder. EDTA, iskeleleri çözmek ve dönüştürülmüş hücreleri izole etmek için kullanılır. PBS ile iki kez yıkandıktan sonra, hücre peleti analiz için kullanılabilir. Kısaltmalar: PBS = fosfat tamponlu salin; PBMC’ler = periferik kan mononükleer hücreleri. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
CAR-T hücre tedavisi hem araştırma hem de ticari uygulamalar için ilgi görmeye devam etmektedir. CAR-T hücre tedavisinin kan kanserlerinin tedavisinde elde ettiği başarıya rağmen, prosedürün yüksek maliyeti kullanımını sınırlar. Burada sunulan protokol, retronektin kaplı plakaların spinokülasyonuna gerek kalmadan T hücrelerinin viral gen transferi için yeni bir yöntem sunmaktadır. Transdüksiyona aracılık etmek için kuru makrogözenekli aljinat iskeleleri üretmek nispeten basittir ve geleneks…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Ulusal Sağlık Enstitüleri tarafından R37-CA260223, R21CA246414 Hibe Ödül Numaraları ile desteklenmiştir. NCSU flow cytometry core’a flow cytometry analizi konusunda eğitim ve rehberlik için teşekkür ederiz. Şemalar Biorender.com ile oluşturuldu
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

