Erkennen von Glykogen in peripheren mononukleären Blutzellen mit Perjodsäure-Schiff-Färbung
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Perjodsäure Schiff (PAS) -Färbung eine immunohistochemische Technik, die weit verbreitet in der Muskel Forschung und Diagnostik eingesetzt wird. Es wird auch als ein diagnostisches Werkzeug für Blutproben verwendet. Diese Technik funktioniert, indem Periodsäure-Lösung zu der Probe, die innerhalb der Polysaccharid Schaffung Aldehydgruppen, die mit dem farblosen Schiffs-Reagenz, wodurch eine tiefmagenta Produkt reagieren Einheiten oxidiert. Die Schritte dieses Verfahrens sind in Abbildung 1 dargestellt. Der Fleck macht nichts mit Polysacchariden magenta, einschließlich Glykogen, Glycoproteine, Glycolipide, Mucinen, oder andere Moleküle mit Polysaccharid-Gruppierungen.
PAS-Färbung wird oft verwendet, um Glykogenspiegel in Muskelfasern messen. Muskeln Gewebeschnitte sind für die Technik, wenn sie fest an dem Schieber aushalten mehrere Wasch- und Färbeschritte. Glykogen ist den meisten in schnell kontra vorhanden Typ-II-Muskelfasern, die einen hohen Bedarf habenfür die schnelle Produktion von ATP Glykogen für maximale Leistung 1,2 erfordern. Glycogen ist ein verzweigtes Polymer von Glucose, die in freie Glucose durch die Wirkung von Glycogenphosphorylase-Enzyme abgebaut werden können. In Zeiten der Ruhe und Nahrungsversorgung, wird Glykogen durch den Prozess der Glykogenese aufgefüllt, während in Zeiten der Mangelernährung oder Hochenergiebedarf; Glykogen in Glukose durch Glykogenolyse gebrochen. Bereits ab den 1950er Jahren Kliniker Wissenschaftler haben erforscht PAS-Färbung auf Blutproben Glykogengehalt bei verschiedenen Erkrankungen 3-7 analysieren. Zum Beispiel bei Morbus Pompe-einer bonafide Glykogenspeicher krankheits- weißen Blutkörperchen sammeln sich große Mengen an Glykogen, die wesentlich von gesunden Kontrollen 8 unterscheidet.
Dieses Video-Artikel beschreibt eine angepasste Version von PAS-Färbung für den Einsatz in peripheren mononukleären Blutzellen (PBMC) Proben von venösem Blut von gesunden Probanden. PBMCs enthalten hauptsächlich Lymphozyten T-Lymphozyten und B-Lymphozyten-Familien, wie auch andere Immunzellen, wie NK-Zellen und Monozyten. Der erste Reinigungsschritt entfernt Erythrozyten, Neutrophilen, Granulozyten und andere. Diese Technik liefert Daten zu einer konzentrierten Anteil der Lymphozyten sich die Robustheit Aufzählung von PAS-positiven Zellen im Vergleich zur Verwendung von Vollblutabstrichen.
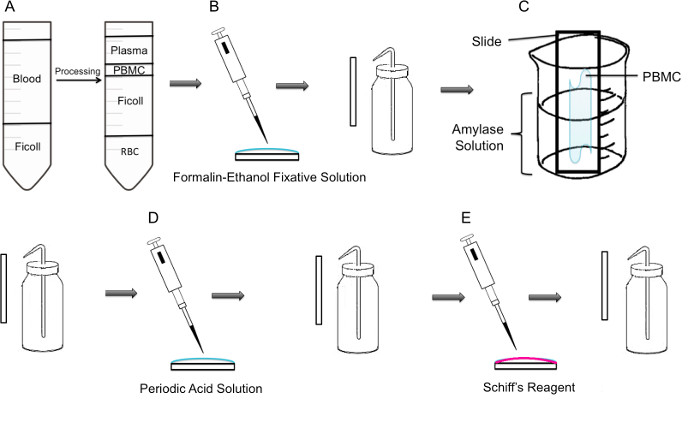
Abb. 1: Schritt für Schritt Methodik der PAS-Färbung auf PBMC (A) Zunächst wird Isolierung von PBMC durch Ficoll Gradienten erreicht, zeigt der linken Seite die Vorbereitung vor dem Zentrifugieren, zeigt sie nach der Zentrifugation im rechten Feld, wo die Speckhaut, die den PBMC ist in der Mitte des Rohres beobachtet. (B) Isolierte PBMC werden auf den Objektträger unter Verwendung von Formalin-ethanol Fixierungslösungen festtion. Der Schieber wird sanft mit destilliertem Wasser aus einer Spritzflasche gespült. (C) Der Objektträger wird dann in einem 100 ml-Becherglas zur Hälfte mit Amylase-Lösung gefüllt, die Glykogen auflöst platziert. Der Objektträger wird vorsichtig gespült. (D) Der Objektträger wird mit Perjodsäure-Lösung, wobei die Oxidation von Sacchariden erfolgt behandelt. Die Objektträger werden schonend gespült; Dies wird das überschüssige Periodsäure zu entfernen und Beenden des Oxidationsschrittes. (E) Wenn der Schiff'schen Reagenz auf den Objektträgern zu, wird es mit Aldehyden während der Oxidationsstufe erstellt reagieren. Dieser farblose Reagenz wird dann in einem tiefrote magenta Produkt führen. Die Objektträger werden schonend gespült, das überschüssige Schiff-Reagenz zu entfernen.
Protocol
Representative Results
Discussion
Die kritischen Schritte dieses Video Artikel waren beim Waschen und Amylase-Behandlung der Zellen. Beim Waschen der Objektträger wurde der entscheidende Schritt mit einem Kunststoff squeezable Waschflasche und ließ das Wasser sanft durch die Probe auf dem Objektträger laufen und nicht direkt mit dem Ziel auf die Proben. Selbst die geringste direkte Wasserdruck würde die Zellen veranlassen, kommen aus der Folie. Ein weiterer wichtiger Schritt war, um dieselbe Folie für ± Amylase Bedingungen. Nachdem die PBMCs mit d…
Declarações
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
Referências
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Bioquímica. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

