Rilevamento glicogeno in cellule periferiche mononucleate del sangue con Periodic Acid Schiff colorazione
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Acido periodico Schiff (PAS) è una tecnica di colorazione immunoistochimica che è ampiamente utilizzato nella ricerca e diagnostica muscolare. Viene anche utilizzato come strumento diagnostico su campioni di sangue. La tecnica funziona applicando soluzione di acido periodico al campione, che ossida unità all'interno dei polisaccaridi creazione di gruppi aldeidici che reagiscono con il reagente di Schiff incolore producendo così un prodotto magenta profondo. I passi di questa procedura sono mostrati in Figura 1. La macchia gira nulla con polisaccaridi magenta, tra glicogeno, glicoproteine, glicolipidi, mucine, o altre molecole con porzioni polisaccaridi.
Colorazione PAS viene spesso utilizzato per misurare i livelli di glicogeno nelle fibre muscolari. Sezioni di muscoli di tessuto sono ideali per la tecnica in quanto fermamente attribuiscono alla diapositiva e sopportano più fasi di lavaggio e colorazione. Il glicogeno è più presente in contrazione rapida di tipo II fibre muscolari, che hanno una forte domandaper la produzione di ATP rapida richiede glicogeno per il massimo delle prestazioni 1,2. Il glicogeno è un polimero ramificato di glucosio che può essere suddiviso in glucosio libero attraverso l'azione di enzimi glicogeno fosforilasi. In tempi di riposo e nutrizionale-autosufficienza, il glicogeno viene rifornito attraverso il processo di glicogenesi, mentre in tempi di insufficienza o di alta energia domanda nutrizionale; glicogeno è suddiviso in glucosio da glicogenolisi. Dalla già a partire dal 1950 gli scienziati hanno esplorato clinico colorazione PAS su campioni di sangue per analizzare il contenuto di glicogeno in varie malattie 3-7. Ad esempio, in Pompe malattia un accumulo di glicogeno autentico globuli bianchi alle malattie accumulano grandi quantità di glicogeno che differisce significativamente da controlli sani 8.
Questo video-articolo illustra una versione adattata di colorazione PAS per l'uso su cellule mononucleate del sangue periferico (PBMC) campioni di sangue venoso di soggetti umani sani. PBMCs contengono principalmente linfociti del linfociti T e B famiglie linfociti, così come altre cellule immunitarie come le cellule killer naturali e monociti. La prima fase di purificazione rimuove eritrociti, neutrofili e altri granulociti. Questa tecnica fornisce dati su una proporzione concentrata di linfociti consentendo più robusta enumerazione delle cellule PAS-positive rispetto all'utilizzo strisci di sangue intero.
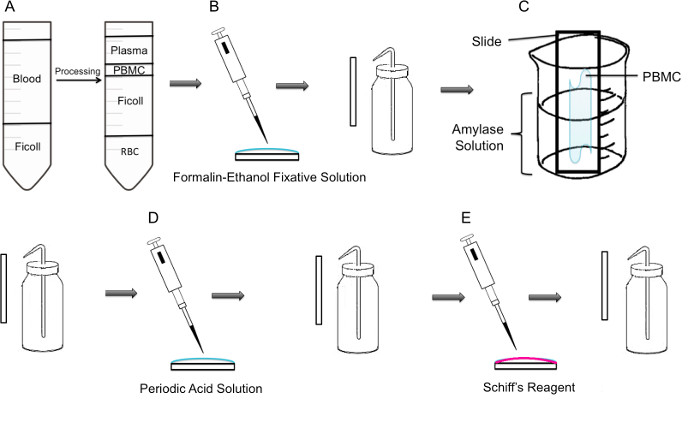
Figura 1:. Passo dopo passo la metodologia di colorazione PAS su PBMC (A) In primo luogo, l'isolamento delle PBMC è ottenuta attraverso Ficoll gradiente, il pannello di sinistra mostra la preparazione prima della centrifugazione, il pannello di destra mostra che dopo centrifugazione dove il cappotto buffy contenente il PBMC si osserva nel centro del tubo. (B) Isolamento PBMC sono fissati su vetrino utilizzando formalina-etanolo solu fissativezione. Il vetrino viene delicatamente risciacquato con acqua distillata da una spruzzetta di plastica. (C) Il vetrino viene quindi posto in un becher da 100 ml a metà riempito con soluzione di amilasi, che si dissolverà glicogeno. Il vetrino viene delicatamente risciacquato. (D) La slitta viene trattato con soluzione di acido periodico, in cui l'ossidazione dei saccaridi avviene. I vetrini sono sciacquati delicatamente; Questa operazione rimuoverà l'acido periodico eccesso e fermare la fase di ossidazione. (E) Quando il reagente di Schiff viene aggiunta ai vetrini, esso reagirà con aldeidi creati durante la fase di ossidazione. Questo reagente incolore sarà quindi ottenere un prodotto magenta rosso intenso. I vetrini sono delicatamente risciacquate per rimuovere l'eccesso di reagente di Schiff.
Protocol
Representative Results
Discussion
Le fasi critiche di questo articolo video erano durante il lavaggio e amilasi trattamento delle cellule. Mentre si lava le diapositive, il passo fondamentale stava usando una bottiglia di plastica di lavaggio squeezable e lasciando scorrere l'acqua dolcemente attraverso il campione sul vetrino e non puntando direttamente sui campioni. Anche la minima pressione dell'acqua diretta potrebbe causare le cellule a venire fuori la diapositiva. Un altro passo fondamentale è stato quello di utilizzare lo stesso scivolo …
Declarações
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
Referências
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Bioquímica. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

