過ヨウ素酸シッフ染色で末梢血単核細胞中のグリコーゲンの検出
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
過ヨウ素酸シッフ(PAS)染色は広く、筋肉の研究および診断に使用されている免疫組織化学的手法である。また、血液サンプルの診断ツールとして利用されている。技術は無色シッフ試薬、それにより深いマゼンタ生成物を生成物と反応アルデヒド基を生成する多糖類内のユニットを酸化したサンプルに過ヨウ素酸ナトリウム溶液を適用することによって機能する。この手順のステップは、図1に示されている。汚れが多糖部分を有するグリコーゲン、糖タンパク質、糖脂質、ムチン、または他の分子を含む多糖類マゼンタで何をオン。
PAS染色は、多くの場合、筋線維におけるグリコーゲンレベルを測定するために使用される。筋肉組織切片彼らはしっかりとスライドに付着し、複数の洗浄と染色工程に耐えるような技術に最適です。グリコーゲンは、高い需要があり、タイプII筋線維、速筋の中で最も存在する最大パフォーマンス1,2のためのグリコーゲンを必要とする迅速なATP産生のために。グリコーゲンは、グリコーゲンホスホリラーゼ酵素の作用を介して遊離グルコースに分解することができるグルコースの分岐ポリマーである。栄養不足や高エネルギー需要の時代にしながら、休息と栄養自給の時代には、グリコーゲンは、グリコーゲン合成のプロセスを経て補充される。グリコーゲンは、グリコーゲン分解によるグルコースに分解される。血液サンプル上で、早ければ1950年の臨床医科学者が調査してきたように、PAS染色からは、様々な疾患3-7のグリコーゲン含有量を分析する。例えば、ポンペ病、真正グリコーゲン貯蔵において、疾患白血球は健常対照8と大きく異なるグリコーゲンを大量に蓄積する。
このビデオ資料は、末梢血単核細胞(PBMC)健常なヒト被験者の静脈血からのサンプル上で使用するためのPAS染色の適合したバージョンを示す。 PBMCsは主にTリンパ球のリンパ球およびBリンパ球のファミリー、ならびにナチュラルキラー細胞および単球のような他の免疫細胞を含む。最初の精製工程は、赤血球、好中球、および他の顆粒球を除去する。この技術は、全血塗抹標本を使用する場合と比較して、PAS陽性細胞のより堅牢な列挙を可能にするリンパ球の濃縮された割合のデータを提供する。
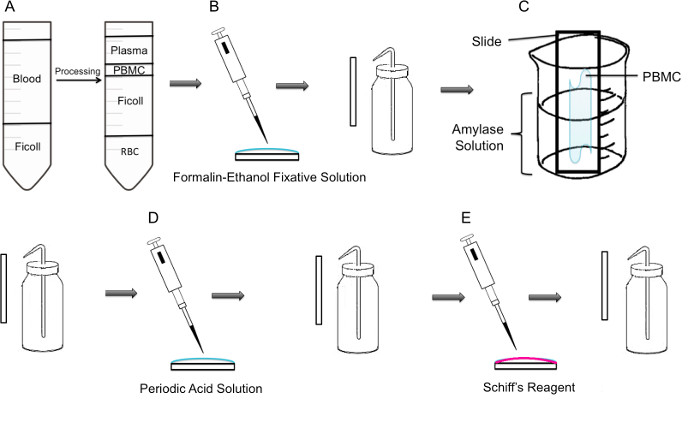
図1:PBMC上のPAS染色の段階の方法論によって、工程(A)まず、PBMCの単離はFicoll勾配を介して達成されるが、左側のパネルには、遠心分離前の準備を示し、右側のパネルには、遠心分離後にそれを示してPBMCを含む軟膜チューブの中心に観察される。(B)単離されたPBMCは、ホルマリン、エタノール固定剤ソリューを用いてスライド上に固定されているる。スライドを穏やかにプラスチック洗浄瓶からの蒸留水で洗浄する。(C)スライドは、次に、グリコーゲンを溶解するアミラーゼ溶液で満たされた100mlビーカー途中に配置される。スライドを穏やかにリンスした。(D)スライドは糖の酸化が起こる周期的な酸溶液で処理される。スライドを軽くすすぐ。これは、過剰の過ヨウ素酸を除去し、酸化工程を停止します。(E)シッフ試薬をスライドに添加される場合には、酸化工程中に作成されたアルデヒドと反応する。この無色の試薬は、その後、深い赤マゼンタ製品になります。スライドを静かに過剰シッフ試薬を除去するために洗浄する。
Protocol
Representative Results
Discussion
このビデオ記事の重要なステップは、細胞の洗浄およびアミラーゼ治療中であった。スライドを洗浄しながら、重要なステップは、プラスチック製のスクイーズ洗浄瓶を使用して、水が軽くスライド上のサンプルを介して実行させると、サンプル上に直接狙っていなかった。少しでも直接水圧は、細胞がスライドをオフに来てしまいます。もう一つの重要なステップは、±アミラーゼ条件に?…
Declarações
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
Referências
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Bioquímica. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

