溶出动态核极化仪器用NMR实时酶反应速率测量
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
基于NMR的调查的主要限制是低灵敏度。这提示对于长采集时间,从而防止代谢转换的实时NMR测量。通过溶解DNP极化绕过灵敏度的一部分发出得益于大外的平衡核磁化从电子到核自旋极化转移而产生。得到高的NMR信号可用于实时监测化学反应。超极化NMR的缺点在于可用于信号采集,这通常是核自旋的纵向弛豫时间常数 ,T 1,或的量级,在有利的情况下,在有限的时间窗口中,与相 关的松弛时间常数的量级加上核的单线态,T LLS。内源性分子和代谢率的细胞摄取可以提供对肿瘤发展和药物反应的基本信息。怒江瓣先前超极化NMR研究已经证明丙酮酸的关联性作为用于在体内监测酶活性的代谢底物。这项工作提供了用于酶反应的研究所需的实验装置和方法的详细描述,尤其是在乳酸脱氢酶(LDH)的存在丙酮酸至乳酸的转化率,通过超极化NMR鉴定。
Introduction
动态核极化(DNP),1,2-旨在加强核自旋极化, 即与“向上”和“向下”的自旋人群(P =不平衡的技术[N↑ – N↓] / [N↑+ N ↓]),最早是在1950年推出。核自旋如13 C能在良好的条件被极化到 P = 10 -1,典型地在1的K的量级的温度下和在3.357磁场T. 3,4-一种用于生物应用的突破是在2000年初与溶解的DNP的发展其由在过热水 中溶解的冷冻极化样品,同时保持在低温下获得的高核极化水平。5所述的液状NMR信号增强由一个因子10 3 -10 4相比共同热极化RT NMR条件。因此溶解DNP提供了一种方法,以在实时原位非侵入测量生化反应速率,允许通过NMR监测动力学与1秒或更小的时间分辨率。6 – 10它也成为可能检测非常低浓度的分析物11。
间的非侵入性的分子成像方式,超极化的核磁共振是,允许同时测量基底和其代谢产物进行实时的唯一技术。溶解DNP用在各种科学领域从体外核磁共振到临床MRI 12和最有前景的应用热情接收都涉及到在现场监测代谢。13,14溶出DNP的主要限制在于,一个时间上后的纵向弛豫时间五倍常数 T 1的顺序,增强极性化都将丢失。因此,有必要使用分子轴承表现出相对长 T 1的核自旋。为了延长极化增强的时间跨度,慢慢松弛核自旋态称为寿州(LLS),可使用15 – 17 LLS是不敏感的对内偶极-偶极相互作用,因此它们的特征弛豫时间常数 ,T LLS,可以更长于 T 1。18数十分钟的磁化寿命,因此,以1小时可以得到,19,20和LLS已经提出了用于两磁共振波谱(MRS)和MRI。21
需要用于通过超极化NMR研究酶反应速率来仔细优化的要点是:(i)最大化固态极化和(ii)的超极化溶液从在传送过程中最小化的偏振损耗偏光片到核磁共振波谱仪。本文介绍了一个特制的溶解DNP设备和喷射系统的适应性研究酶促反应。的特点和设置的性能将与知名的和广泛使用的超极化基板[1- 13 C]的丙酮酸证明。这使得监控反应过程几分钟;第二,它的核心作用这一选择的原因主要是,第一,它的自然长13 C纵向弛豫时间(在高磁场和温度超过293度牛逼 1> 50秒)癌症的代谢。13,14使用溶解DNP NMR和定制开发喷射系统,丙酮酸通过乳酸脱氢酶(LDH)催化的氧化可以在未标记的乳酸9,22的初始池的或不加入未标记乳酸盐存在进行监控,如下图所示。它已经显示在vi测定的[1- 13 C]乳酸盐信号VO(包括细胞)的超极化[1- 13 C]丙酮酸的喷射以下的主要原因是丙酮酸和乳酸之间,而不是乳酸产生一个快速标签交换6
这里我们提出了实时生产[1- 13 C]乳酸从注入到包含LDH一个NMR管中但最初没有乳酸超极化[1- 13 C]丙酮酸盐。
系统描述
有在溶解DNP设置两个主要部分( 图1):对DNP偏振器和NMR波谱仪。对DNP偏振器的主要元件是低温恒温器,以在一个泵送氦浴样品冷却到大约1K的。低温恒温器被插入在一个3.35Ť超导磁铁,并且具有保证具有在磁铁(图1)的等角点的偏振样品的几何形状。低温恒温器内,所述样品(a)的由核磁共振线圈(B)包围,以测量偏振buildup,包含在过模微波腔体(C)。整个样本被保持在一个泵送氦浴(D)低的温度和通过所述波导的微波照射。整个系统由定制软件(图2D)进行管理。
硬件和执行DNP所需的深冷设备和随后的溶解仍然是一个技术挑战。新DNP低温恒温器23,24的开发和测试,以确定其低温性能,然后快速降温,氦保持时间和最小的总消耗的氦操作过程中进行了优化。
低温恒温器由两个部分组成。低温恒温器的第一部分是绝缘杜瓦(图2A),可以在顶端部大致分开(一个)的尾部,或者样品的空间(b)中,与外真空室(OVC)保持在高真空和壳体的下辐射屏幕(c)所示。低温恒温器的第二部分是在主SERT(图2B),放入绝缘杜瓦,其中所有的流量的规定进行管理。液态氦通过传输线(一)从外部存储杜瓦到来,是在分离器(B)中冷凝的第一级,中间室中使用既能保持低温恒温器冷的顶端部分,并除去蒸馏的氦在转移过程中。分离器压力是通过围绕低温恒温器的顶部缠绕的毛细管(C)的泵送降低;冷氦在此毛细管的流用于冷却在绝缘杜瓦(OVC)的挡板(d)和所述辐射屏。将样品置于和偏振中的样本的空间。样品空间被连接到通过另一个毛细管(e)该分离器,围绕主低温恒温器插入件的尾部缠绕。此毛细管可以通过从外部手动操作的针阀被打开或关闭。
为了实现DNP PR过程中使用的温度低ocess,液氦需要在低温恒温器样品空间被收集和其压力降低到毫巴范围。所需的低温恒温器的操作的操作是通过一个相当复杂的泵送系统具有三套泵,监测,并与电子和电机械仪器(图2C)的不同点操作的执行。低温恒温器OVC需要由第一泵系统泵送至在高真空。该系统由通过旋转泵(一)备份涡轮分子泵。液态氦从通过低温恒温器输送线路入口到低温恒温器分离器的存储杜瓦(B)传送。隔板具有连接到所述第二泵送组的出口。这组由35 立方米 /小时隔膜泵(三)。这条线,可除去从杜瓦和分离冷却过程中传输过程中煮氦气。在分离器中收集的液体氦然后可通过盖传送到样本空间上述illary管。从分离器传输液氦到样本空间,并随后以较低的采样空间压力毫巴范围内,250 米 3 /小时罗茨构成的第三泵系统泵由65 米 3 /小时旋转泵(四)备份通过手动蝶阀(E)连接到低温恒温器。
所有的真空系统的操作控制,并通过一个电气定制设备(F)调节。此装置控制低温恒温器分离器(克)和样品空间(H)网点,第二/第三泵送系统(C,D),一个压缩氦瓶(i)和外部之间真空管线连接。 (f)和外部之间的通信通过一个单向阀(J)。电 – 气动装置(F),以及所有的系统参数和溶出硬件通过用普通PC定制的电子设备接口的USB控制和操作。最后,所有的系统,通过电子装置中,是通过在相关操作是通过一个接口使用软件按键发起定制独立的软件(图2D)进行管理。
管理样品并测量被用于一系列插入物的固体状态( 图3A)的NMR信号积聚。为了准备极化冷冻切片机,将(一)主要样本插入,进入低温恒温器。主样品插入件设置有放置在过模镀金微波腔内的NMR线圈(b)中。预冷冻含有溶液的基片进行极化的在液氮温度(偏光溶液)在适宜的样本容器,并将其放置在玻璃纤维样本保持器(C)的端底部。样品架滑入主要样本插入到达磁体等中心。插入在样品支架上的镀金波导(d)所示。波导允许从外部的微波源产生的微波以最小的损失吨至游澳样本。
为低温恒温器管理的定做软件自动处理,当点击相应的接口按钮,不同的操作一样冷却(低温恒温器温度接近降低到液体氦温度),填充(低温恒温器充满液体氦到预先确定的电平),冷却至 T≈1 K(液态氦浴泵送至达到的最低温度可能),加压的附加 步骤(低温恒温器被稍微高于在P房压力加压= 10-30毫巴,以允许低温恒温器开口不会危害由空气中的低温恒温器的污染),并溶解(自动程序以溶解DNP样品,将所得的超极化溶液转移到测量部位,即核磁共振光谱仪)。
进行偏振照射微波的样品在94千兆赫(在偏振场 B 0 </sUB> = 3.35 T)。一个样本后3个T DNP,其中T是DNP极化产生时间:T DNP是由于震级在给定场和温度固态靶核的纵向弛豫时间的顺序相同才算完全极化。在我们所有的实验中,样品被极化超过5吨的DNP。
在的极化时间结束时,将样品必须被溶解在为了一个的RT溶液用于酶活性的测量。在溶解过程中,加入5ml的过热D 2从溶解插入物( 图3B)的锅炉O均为由压缩氦气(P = 6-8巴)推到到达DNP增强样品和溶解。将所得的超极化溶液通过压缩氦气压出溶解的插入,通过溶解插入插座(图3C-B </s仲>),2毫米内径特氟隆传输管。所需的溶解过程的时间是300毫秒。23需要从DNP偏振器的样品转移至NMR波谱仪站点的时间是大约3秒。
使用溶解插入物( 图3B)进行溶解过程。溶解插入是由一个电子 – 气动组件(a)的,含在气动组件的锅炉和样本容器更衣室(c)中,它允许防漏耦合与样品之间的连接管的碳纤维棒(二)容器,以及背出到出口。电-气动组件(图3C)被用于生产,并通过碳纤维棒驱动过热D 2 O中的样品容器,然后以提取从低温恒温器的超极化溶液。电 – 气动组件由用于控制共之间的连接气动阀(一)的mpressed氦(P = 6-8巴)线(b)中,其中D 2 O中,通过阀(D)中喷射出的锅炉(c)和所述出口(e)通过所述的碳纤维棒(F)。该系统由一个压力G,温度计和在锅炉(c)一种加热电阻丝,一触发(h)及用于连接系统与电子管理装置的连接盒(ⅰ)完成。
对DNP低温恒温器和NMR波谱仪是由传输线, 即,溶解被触发当两个内径在其内部的超极化溶液通过加压氦气压(P = 6-8巴)的PTFE管相连。
溶解序列由下列操作组成:在第一300毫秒,过热D 2 O中被推到样品容器,以便熔化和溶解该超极化的冷冻溶液中。此后,超极化溶液从低温恒温器被PRES的平均提取surized(P = 6-8栏)氦气,通过2个内径聚四氟乙烯管推(图3C-E),可在注射与任一步骤中描述的步骤进行测量点6.2.1或6.2步0.2。
溶解DNP核磁共振设置的第二个组件是NMR波谱仪。在本文所描述的设置中,NMR波谱仪在一个场 B 0 = 11.7特斯拉操作。一个5毫米的NMR探头来测量解散后超极化的信号。该核磁共振波谱仪通过核磁共振控制台操作,使用了固态和液态核磁共振测量,以及公司提供的软件XWinNMR。一个典型的测定由低翻转角硬脉冲(或者校准,为liquidstate或未校准的,固态的测量),接着在信号采集。
固态热极化信号与DNP-的Si的测量gnal集结使用定制的13 C在线圈耦合到核磁共振波谱仪的DNP偏振器( 图3AB)的现场进行。在这种特定情况下的NMR波谱仪不执行信号锁定。当固态测量进行,以避免显著扰动偏振,采集之间的时间延迟应足够长,比至 0.5吨的DNP大致更长。
固态增强被定义为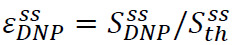 哪里
哪里![]() 在超极化信号(步骤3.3获得)和
在超极化信号(步骤3.3获得)和![]() 是固态信号(在泵送液体氦温度在步骤3.2在热平衡获得)(图4A)。此参数Defines可用于NMR实验的最大极化之前,超极化溶液的转移过程中不可避免的损失。测量是使用一个未校准的低翻转角脉冲的简单脉冲采集序列进行。脉冲校准通常跳过固态测量。
是固态信号(在泵送液体氦温度在步骤3.2在热平衡获得)(图4A)。此参数Defines可用于NMR实验的最大极化之前,超极化溶液的转移过程中不可避免的损失。测量是使用一个未校准的低翻转角脉冲的简单脉冲采集序列进行。脉冲校准通常跳过固态测量。
类似的方法可用于确定在液体状态下的超极化的信号增强。在这种情况下,放置在分光计管注射前的样本(步骤6.2)组成的500μl的D 2 O的溶解和注射后,有监视两个重要参数。第一个是在NMR波谱仪站点的超极化增强, 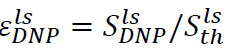 (图4B),其中
(图4B),其中![]() 是信号只是超注射后偏振光溶液(步骤7.1获得)和
是信号只是超注射后偏振光溶液(步骤7.1获得)和![]() 是热极化信号(步骤7.2获得)。第二个是纵向弛豫时间T 1(图4B,插图),与基板和各代谢产物(通过在步骤7.1获得的指数拟合信号获得)相关联。这两个参数定义必要获得足够的信噪比(SNR)和对代谢转换的测量可用的时间窗的最小底物浓度。固态极化之间的比例
是热极化信号(步骤7.2获得)。第二个是纵向弛豫时间T 1(图4B,插图),与基板和各代谢产物(通过在步骤7.1获得的指数拟合信号获得)相关联。这两个参数定义必要获得足够的信噪比(SNR)和对代谢转换的测量可用的时间窗的最小底物浓度。固态极化之间的比例![]() 和liquidstate极化
和liquidstate极化![]() 给出了超极化溶液转移过程中的极化损失,由于松弛的估计。值ation12“SRC =”/文件/ ftp_upload / 53548 / 53548equation12.jpg“宽度=”80“/>应在不存在松弛的损失被观察到。
给出了超极化溶液转移过程中的极化损失,由于松弛的估计。值ation12“SRC =”/文件/ ftp_upload / 53548 / 53548equation12.jpg“宽度=”80“/>应在不存在松弛的损失被观察到。
Protocol
Representative Results
Discussion
溶解DNP核磁共振实验的关键点是:(i)偏振的实现为基材的水平,它决定所必需的实验最低的产品浓度以及能够进行和(ii)的寿命信号的采集次数磁化的,相比于偏振和检测位点之间,并以基板转化率传输的持续时间。本文描述的溶出DNP设置的喷射系统允许在低至3-4秒样品转移。虽然转印不如在由S. Bowen和C. Hilty提出的方法为快速,丙酮酸26极化损失由于在低场的中等纵向弛豫限制。 [1- …
Declarações
The authors have nothing to disclose.
Acknowledgements
作者感谢JJ博士范德克林克在选择和组装设备的帮助,以及F.凯笛博士和G. Bertho博士有益的讨论。交流是由瑞士国家科学基金会(授予PPOOP2_157547)的支持。我们承认从巴黎索邦太阳城(NMR @ COM中,DIM分析,威乐巴黎,基金会德拉RECHERCHE MEDICALE(FRM ING20130526708)和Parteneriat休伯特·居里安布朗库西32662QK融资。我们的团队是Equipex计划巴黎烯共振的一部分和CACSICE。
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
Referências
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

