Растворение динамическая поляризация ядер Инструментарий в реальном времени ферментативной реакции Стоимость Измерения с помощью ЯМР
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
Основным ограничением ЯМР основе исследований является низкая чувствительность. Это побуждает течение долгого времени приобретения, тем самым предотвращая измерений методом ЯМР в режиме реального времени метаболических превращений. Гиперполяризация помощью растворения DNP обходит часть чувствительности выдает благодаря большому нестандартного равновесия ядерной намагниченности, вытекающих из передачи спиновой поляризации электрона и ядра. Высокого ЯМР сигнал, полученный могут быть использованы для мониторинга химических реакций в реальном времени. Недостатком гиперполяризованным ЯМР находится в ограниченном временном окне доступных для обнаружения сигнала, которая обычно составляет порядка ядерной спин продольной постоянной времени релаксации, T 1, или, в благоприятных случаях, порядка постоянной времени релаксации, связанной с синглетная сопряженных ядер, Т LLS. Сотовый поглощение эндогенных молекул и скоростей метаболических может оказать существенную информацию о развитии опухоли и ответ наркотиков. Nuполненных ранее многочисленных Гиперпол ризованные ЯМР исследования продемонстрировали релевантность пирувата как метаболический субстрат для мониторинга ферментативную активность в естественных условиях. Эта работа содержит подробное описание экспериментальной установки и методов, необходимых для изучения ферментативных реакций, в частности скорость пируват-к-лактата преобразования в присутствии лактатдегидрогеназы (ЛДГ), по гиперполяризованным ЯМР.
Introduction
Динамическая поляризация ядер (DNP), 1,2 методика предназначена для повышения спиновой поляризации ядерной, т.е. дисбаланс между «вверх» и «вниз» населенностей спиновых (P = [N ↑ – N ↓] / [N ↑ + N ↓]), была впервые введена в 1950-х годах. Ядерные спины, такие как 13 C могут быть поляризованы до P = 10 -1 в благоприятных условиях, как правило, при температуре порядка 1 К и в магнитном поле 3,357 Т. 3,4 Прорыв для биологических применений пришел в начале 2000-х с развитием растворения DNP который состоит в растворении замороженных поляризованных образцов в перегретой воды при сохранении высокого уровня ядерной поляризации, полученной при низкой температуре. 5 жидкость состояния ЯМР сигнал усиливается с коэффициентом 10 3 -10 4, по сравнению с общийтермически поляризованных условия RT ЯМР. Поэтому Растворение DNP обеспечивает способ неинвазивного мерой биохимические скоростей реакций в месте в режиме реального времени, что позволяет динамику мониторинга от ЯМР с временным разрешением 1 сек или меньше 6 -. 10 Также стало возможным обнаружить аналиты в очень низких концентрациях 11.
Среди методов неинвазивной молекулярной визуализации, гиперполяризационная ЯМР является единственным методом, который позволяет одновременно измерения подложку и метаболические продукты в режиме реального времени. Растворение DNP был принят с энтузиазмом в различных научных областях, начиная от в пробирке ЯМР для клинической МРТ 12 и наиболее перспективных приложений связаны с на месте мониторинга метаболизма. 13,14 Основным ограничением для растворения DNP, что через некоторое время на порядок пять раз время продольной релаксации постоянной Т 1, улучшенная полярнаялизации теряется. Именно поэтому необходимо использовать молекулы, несущие ядерные спины, проявляющие относительно длительный T 1. Чтобы продлить время пролета повышения поляризации, медленно расслабляющий ядерных спиновых состояний, известных как долгоживущих состояний (LLS), могут быть использованы 15 -. 17 LLS нечувствительны к диполь-дипольного взаимодействия внутри пары, так что их характерной постоянная времени релаксации, Т РЛС, может быть гораздо больше, чем T 1. 18. намагниченность жизни десятков минут и, следовательно, до 1 часа можно было получить, 19,20 и РЛС были предложены как для магнитно-резонансной спектроскопии (MRS) и МРТ. 21
Основные моменты, которые должны быть тщательно оптимизирован для изучения ферментативных скорость реакции по гиперполяризованным ЯМР являются: (я) максимизировать твердотельный поляризацию и (II) свести к минимуму потери поляризации при передаче гиперполяризованным раствор изполяризатор на ЯМР-спектрометре. В данной статье описывается адаптации заказной растворения DNP аппарата и системы впрыска для изучения ферментативных реакций. Характеристики и производительность установки будет продемонстрирована с известной и широко используемой гиперполяризованным подложке [1- 13 C] пирувата. Основными причинами этого выбора являются, во-первых, его, естественно, долго 13С время продольной релаксации (T 1> 50 сек при высоких магнитных полей и температур выше 293 К), который позволяет реакции мониторинга в течение нескольких минут, а во-вторых, ее центральной роли в рак метаболизм. 13,14 Используя растворения DNP-ЯМР и систему впрыска пользовательский развитая, окисление пирувата, катализируемого лактатдегидрогеназы (ЛДГ) можно контролировать в присутствии начальной бассейне немеченого лактата 9,22 или без каких-либо немеченого лактата добавленной , как показано здесь. Было показано, что [1- 13 С] лактат сигнал измеряется в VIVO (в том числе в клетках) после инъекции гиперполяризованным [1- 13 C] пирувата в основном за счет быстрого обмена этикетки между пирувата и лактата, а не к лактата. 6
Мы здесь, представить продукцию в режиме реального времени [1- 13 C] лактат от гиперполяризованного [1- 13 С] пируват, вводили в ЯМР пробирку, содержащую ЛДГ но изначально не лактата.
Описание системы
Есть две основные части в установке растворения DNP (Рисунок 1): ДНП поляризатор и ЯМР спектрометр. Основным элементом поляризатор DNP является криостат для охлаждения образца до около 1 К в перекачиваемой гелиевой ванны. Криостат вставляется в сверхпроводящем магните 3,35 Тл и имеет геометрию, которая гарантирует, чтобы иметь поляризационный образца при изоцентром магнита (рис 1). Внутри криостата образец (а) окружен катушкой ЯМР (б), чтобы измерить поляризационную бuildup, содержащаяся в overmoded микроволнового резонатора (с). Весь образец выдерживают при низкой температуре в перекачиваемой гелиевой ванны (г) и облучают микроволнами через волновод. Вся система управляется заказ программного обеспечения (рис 2D).
Аппаратное и криогенное оборудование, необходимые для выполнения ДНП и последующее растворение по-прежнему технологической проблемой. Новый DNP криостат 23,24 была разработана и испытана для определения ее криогенных выступления, а затем оптимизирован для быстрого остывания, гелий удержания времени и общей минимальным потреблением гелия во время работы.
Криостат состоит из двух частей. Первая часть криостата, представляет собой изоляцию Дьюара (2А), что может быть грубо разделены на верхней части (а) хвост, или выборочное пространство (б), а наружный вакуумная камера (ВЗУ), выдерживалось при высоком вакууме и корпусом на радиационные экраны (с). Вторая часть криостата является основным вСерт (2В), помещают в сосуд Дьюара изоляции, где удалось все правила потока. Жидкий гелий камеры от внешнего дьюара через линию передачи (в), находится в первой стадии конденсируется в сепараторе (б), промежуточной камеры используется как для поддержания верхнюю часть криостат холодной и снять гелий испаряется во время передачи. Давление сепаратор опускают путем откачки через капилляр (с), обернутой вокруг верхней части криостата; поток холодного гелия в этом капилляре используется для охлаждения перегородки (D) и экраны излучения в изоляционном сосуда Дьюара (ВЗУ). Образец помещают и поляризовано в выборочном пространстве. Выборочное пространство подключен к сепаратору через другую капилляра (E), обернутой вокруг хвостовой части главного криостата вставкой. Это капиллярное может быть открыта или закрыта с помощью игольчатого клапана с ручным управлением снаружи.
Для достижения низкой температуры, используемый в ходе пр DNPocess, жидкий гелий, которые необходимо собирать в криостат выборочного пространства и его давление понижается до мбар диапазоне. Операции, необходимые для работы криостата выполняются через довольно сложной насосной системы с тремя наборами насосов, мониторинга и управления в разных точках с электронными и электромеханических приборов (рис 2С). Криостат ВЗУ должна насосом высокого вакуума на первом насосной системы. Эта система состоит из турбомолекулярным насоса резервной копии с помощью роторного насоса (A). Жидкий гелий передается от дьюара (б) путем передачи криостат впускную линию к криостата сепаратора. Сепаратор имеет выходное отверстие которого соединен со вторым набором накачки. Этот набор состоит из 35 м 3 / ч мембранного насоса (с). Эта линия позволяет удалять газообразный гелий вареной во время передачи от сосуда Дьюара и при охлаждении сепаратора. Жидкий гелий собирали в сепараторе может быть затем переведен в выборочном пространстве через колпачокIllary трубки описано выше. Для передачи жидкого гелия из сепаратора в выборочном пространстве, а затем в нижней выборочном пространстве давлении мбар диапазон, третий насосную систему, состоящую из 250 м 3 / ч насоса Рутса подкреплены 65 м 3 / ч роторного насоса (г) подключен к криостата посредством ручной дроссельный клапан (е).
Все вакуумной системы операции контролируются и регулируются электропневматического заказ устройства (F). Это устройство контролирует соединения вакуумной линии между криостата сепаратора (г) и выборочного пространства (ч) точек, вторые / систем третьих насосных (в, г), сжатым гелием бутылки (I) и за ее пределами. Связь между (F) и снаружи, проходит через односторонний клапан (J). Электро-пневматическое устройство (е), а также все параметры системы и аппаратные Растворение контролируются и управляются с помощью заказного электронного устройства сопряженной USB с общим ПК. Наконец вся система, через электронныйУстройство, управляется на заказ автономным программным обеспечением (рис 2D), где соответствующие операции запускаются через интерфейс с помощью программируемых кнопок.
Чтобы управлять образец и измерить сигнал ЯМР наращивание в твердом состоянии используются ряд вставок (рис 3А). Для приготовления криостат для поляризации, разместить основной вкладыш образца (а), в криостат. Основной вкладыш образец снабжен катушкой ЯМР (б), размещенные внутри overmoded позолоченной микроволнового резонатора. Предварительно заморозить основу, содержащую раствор поляризованным (поляризационный раствор) при температуре жидкого азота в подходящем контейнере образца и поместите его в конце нижней части держателя образца стекловолокна (с). Вставьте держатель образца в основную вставки образца, чтобы достичь магнита изоцентру. Вставьте позолоченный волновод (D) в держателе образца. Волновод позволяет микроволна, генерируемая из внешнего источника микроволнового путешествовать с минимальными потерями тO образца.
Заказ программное обеспечение для управления криостата обрабатывает автоматически, после нажатия соответствующей кнопки интерфейса, различные операции, как кд (температура криостат опускается близко к температуре жидкого гелия), заполняя (криостат с жидким гелием до заранее определенного уровня ), дополнительная стадия охлаждения до T ≈ 1 к (гелий ванны жидкость закачивается достичь самую низкую температуру можно), наддув (криостат слегка под давлением выше давления комнатной при Р = 10-30 мбар, чтобы позволить криостата отверстие без риска загрязнения криостата по воздуху) и растворения (автоматическая процедура для растворения образца DNP и передавать полученную гиперполяризованного раствора к месту измерения, т.е. ЯМР-спектрометра).
Поляризация выполняется облучения образца микроволн при 94 ГГц (в поляризационный поля B 0 </sUB> = 3,35 Т). Образец считается полностью поляризованным после 3 T DNP, где Т ДПЯ время поляризации наращивание. Т DNP имеет тот же порядок, что и время продольной релаксации ядер мишени в твердом состоянии при заданной поля и температуры. Во всех наших экспериментах образец поляризован в течение более 5 Тл DNP.
В конце времени поляризации, образец должен быть растворен в растворе РТ в целях быть использован для измерения ферментативной активности. Во время процесса растворения, 5 мл перегретого D 2 O из котла для растворения вставки (фиг.3В) выталкиваются с помощью сжатого газообразного гелия (P = 6-8 бар), чтобы достичь DNP-расширенную выборку и растворить его. Полученный раствор гиперполяризационная выталкивается вставку растворения сжатым газообразным гелием, через выпускное отверстие растворение вставки (Фигура 3С-б </sЧонг>), 2 мм внутренний диаметр передача тефлон трубка а. Время, необходимое для процесса растворения составляет 300 мс. 23 Время, необходимое для передачи образца от поляризатора DNP на спектрометр сайта ЯМР составляет около 3 сек.
Процесс растворения проводят с использованием растворения вставку (фигура 3В). Вставка растворения состоит из электронно-пневматическая сборки (а), углеродное волокно палочка (б), содержащий соединительные трубки между котлом в пневматическом собраний и шкафчик образец контейнера (С), что позволяет герметичное соединение с образцом контейнер, и обратно к выходу. Электропневматический сборки (фиг.3С) используется для производства и приводной перегретого D 2 O через углеродного волокна палки, чтобы контейнер для образца, а затем извлечь гиперполяризованного раствора из криостата. Электропневматический сборка состоит из пневматических клапанов (а), которые контролируют соединения между взаимодействующимиmpressed гелий (Р = 6-8 бар) линия (б), котел (с), где D 2 O вводят через клапан (D), а выпускное отверстие (е) через углеродного волокна палки (е). Система завершается G давления, термометром и нагревательной нагревательными проводами в котле (с), триггер (H) и соединительной коробке (I), используемого для взаимодействия системы с устройством электронного управления.
DNP криостат и ЯМР спектрометр соединен посредством линии передачи, т.е. ПТФЭ трубки 2 мм внутреннего диаметра, внутри которой гиперполяризационная раствор выталкивается гелия под давлением (Р = 6-8 бар) при растворение инициируется.
Последовательность растворения состоит из следующих операций: в первые 300 мс, перегретый D 2 O была помещена в контейнер для образца для того, чтобы расплавить и растворить гиперпол замороженного раствора. После этого гиперполяризационная раствор экстрагируют из криостата среднем врпродувается (Р = 6-8 бар) газообразный гелий и протолкнул внутренний диаметр ПТФЭ трубки 2 мм (Фигура 3С-е) к участку измерения, где впрыск осуществляется с любой из процедур, описанных в шаге 6.2.1 или Шаг 6.2 0,2.
Второй компонент растворения установки DNP ЯМР является ЯМР спектрометр. В установке, описанной в данном описании, ЯМР-спектрометр работает при поле В 0 = 11,7 Тесла. В 5 мм ЯМР зонд используется для измерения гиперполяризованного сигнал после растворения. ЯМР спектрометр работает через консоль ЯМР, используется как для твердотельных и жидкостных государственных ЯМР измерений, а фирма-прилагающееся программное обеспечение XWinNMR. Типичный измерение состоит из низким углом флип жесткий импульса (либо откалиброван, для liquidstate или снимите откалиброван, для твердотельных измерений) с последующим сигнальных поглощений.
Измерения твердотельного сигнала тепловой поляризации и DNP-производного сигнал наращивание выполняются с использованием заказных катушку 13 C в месте DNP поляризатор (рис 3AB), соединенного с ЯМР-спектрометра. В данном конкретном случае ЯМР спектрометр не выполняет блокировку сигнала. Когда твердотельные измерения проводятся, чтобы избежать значительных возмущений в поляризацию, задержка между поглощений должна быть достаточно длинной, примерно длиннее 0,5 Тл DNP.
Повышение твердотельный определяется как 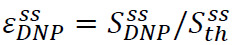 где
где ![]() является гиперполяризационная сигнала (полученного на стадии 3.3) и
является гиперполяризационная сигнала (полученного на стадии 3.3) и ![]() это твердотельный сигнала (получается при тепловом равновесии при накачке температуре жидкого гелия в шаге 3.2) (4А). Этот параметр defines максимальную поляризацию, доступной для экспериментов ЯМР, до неизбежных потерь при передаче гиперполяризованным раствора. Измерение производится с помощью простого последовательности импульсов приобретают использованием не-откалиброван с низким флип угол пульс. Калибровка импульсов обычно пропускаются для твердотельного измерений.
это твердотельный сигнала (получается при тепловом равновесии при накачке температуре жидкого гелия в шаге 3.2) (4А). Этот параметр defines максимальную поляризацию, доступной для экспериментов ЯМР, до неизбежных потерь при передаче гиперполяризованным раствора. Измерение производится с помощью простого последовательности импульсов приобретают использованием не-откалиброван с низким флип угол пульс. Калибровка импульсов обычно пропускаются для твердотельного измерений.
Аналогичную процедуру можно использовать для определения усиления гиперпол сигнала в жидкой государства. В этом случае образец помещают в спектрометре трубки перед инъекцией (Шаг 6.2) состоит из 500 мкл D 2 O. После растворения и инъекции, есть два важных параметра для мониторинга. Во-первых, гиперполяризационная повышение на участке ЯМР спектрометра, 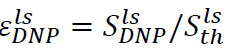 (4В), где
(4В), где ![]() это сигнал сразу после инъекции гипер поляризованный раствор (полученный на стадии 7.1) и
это сигнал сразу после инъекции гипер поляризованный раствор (полученный на стадии 7.1) и ![]() тепловая сигнал поляризации (полученный на стадии 7.2). Во-вторых, время продольной релаксации, T 1 (Фиг.4В, вставка), связанный с подложкой и каждой продукта метаболизма (полученного экспоненциальной подгонки, сигналов, полученных на шаге 7.1). Эти два параметра определяют минимальную концентрацию субстрата, необходимого для получения достаточного отношения сигнал-шум (SNR) и доступного временного окна для измерения метаболических превращений. Соотношение между твердотельным поляризации
тепловая сигнал поляризации (полученный на стадии 7.2). Во-вторых, время продольной релаксации, T 1 (Фиг.4В, вставка), связанный с подложкой и каждой продукта метаболизма (полученного экспоненциальной подгонки, сигналов, полученных на шаге 7.1). Эти два параметра определяют минимальную концентрацию субстрата, необходимого для получения достаточного отношения сигнал-шум (SNR) и доступного временного окна для измерения метаболических превращений. Соотношение между твердотельным поляризации ![]() и liquidstate поляризации
и liquidstate поляризации ![]() дает оценку потерь поляризации за счет релаксации в процессе передачи гиперполяризованным раствора. Ценностьation12 "SRC =" / файлы / ftp_upload / 53548 / 53548equation12.jpg "ширина =" 80 "/> должен наблюдаться в отсутствие релаксационных потерь.
дает оценку потерь поляризации за счет релаксации в процессе передачи гиперполяризованным раствора. Ценностьation12 "SRC =" / файлы / ftp_upload / 53548 / 53548equation12.jpg "ширина =" 80 "/> должен наблюдаться в отсутствие релаксационных потерь.
Protocol
Representative Results
Discussion
Критические точки растворения DNP ЯМР эксперимента: (я) уровень поляризации достигается при подложки, которая определяет самую низкую концентрацию продукта, необходимого для экспериментов, а также ряд приобретений сигналов, которые могут быть выполнены и (II) времен жизни намагниченнос?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят доктора JJ ван дер Klink за помощь в выборе и монтаже оборудования, а также д-ра Ф. Катеб и д-ра Г. Bertho за полезные обсуждения. AC была поддержана Национальным научным фондом Швейцарии (грант PPOOP2_157547). Мы признаем финансирование из Парижской Сорбонны Сите (ЯМР @ Com, DIM Analytics, мэрии Парижа, в Fondation де ла Recherche MEDICALE (FRM ING20130526708), и Parteneriat Hubert Кюрьен Бранкузи 32662QK. Наша команда является частью Equipex программ Париж-ан-резонансной и CACSICE.
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
Referências
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

