Dissolution Polarisation Dynamique Nucléaire Instrumentation pour en temps réel la vitesse de réaction enzymatique mesures par RMN
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
La principale limitation des enquêtes à base de RMN est faible sensibilité. Cette demande pour des temps d'acquisition longues, empêchant ainsi les mesures de RMN en temps réel des transformations métaboliques. Hyperpolarisation par dissolution DNP contourne une partie de la sensibilité émet grâce à la grande magnétisation nucléaire hors d'équilibre résultant de la cession polarisation de spin électronique à noyau. Le signal de RMN haute obtenu peut être utilisé pour contrôler des réactions chimiques en temps réel. L'inconvénient de hyperpolarisé RMN réside dans la fenêtre de temps disponible pour l'acquisition du signal, qui est généralement de l'ordre de la direction longitudinale constante de temps de relaxation de spin nucléaire, T 1, ou, dans les cas favorables, de l'ordre de la constante de temps de relaxation associé à la-singulet de noyaux couplés, T LLS. absorption cellulaire de molécules endogènes et les taux métaboliques peut fournir des informations essentielles sur le développement de la tumeur et la réponse aux médicaments. Nuétudes RMN hyperpolarisés précédentes nom- ont démontré la pertinence de pyruvate comme substrat métabolique pour surveiller l'activité enzymatique in vivo. Ce travail fournit une description détaillée du dispositif expérimental et les méthodes nécessaires à l'étude des réactions enzymatiques, en particulier le taux de pyruvate à lactate conversion en présence de lactate déshydrogénase (LDH), par RMN hyperpolarisé.
Introduction
Polarisation nucléaire dynamique (DNP), 1,2 une technique visant à renforcer la polarisation de spin nucléaire, à savoir, le déséquilibre entre le «haut» et les populations «bas» de spin (P = [N ↑ – N ↓] / [N ↑ + N ↓]), a été introduit dans les années 1950. Spins nucléaires tels que 13 C peuvent être polarisés jusqu'à P = 10 -1 dans des conditions favorables, typiquement à une température de l'ordre de 1 K et dans un champ magnétique de 3.357 T. 3,4 Une percée pour les applications biologiques est venu dans la début des années 2000 avec le développement de dissolution DNP qui consiste à dissoudre les échantillons polarisés gelés dans de l'eau surchauffée, tout en conservant le niveau de polarisation nucléaire à haute obtenue à basse température. 5 le signal RMN à l'état liquide est améliorée d'un facteur 10 3 -10 4 par rapport à communthermiquement polarisée conditions RT RMN. Dissolution DNP fournit donc un moyen de non-invasive mesure biochimique des vitesses de réaction in situ en temps réel, ce qui permet une dynamique de contrôle par RMN avec une résolution temporelle de 1 s ou moins. 6 – 10 Il est également devenu possible de détecter des analytes à des concentrations très faibles 11.
Parmi les modalités moléculaires imagerie non invasives, RMN hyperpolarisé est la seule technique qui permet de mesurer à la fois un substrat et ses produits métaboliques, en temps réel. Dissolution DNP a été accueillie avec enthousiasme dans divers domaines scientifiques allant de in vitro RMN à l'IRM clinique 12 et les applications les plus prometteuses sont liées à la surveillance in situ du métabolisme. 13,14 La principale limitation de dissolution DNP est que, après un certain temps sur l'ordre de cinq fois le temps de relaxation longitudinale T 1 constant, la améliorée polairesation est perdue. Il est donc nécessaire d'utiliser des molécules portant des spins nucléaires présentant relativement longue T 1. Pour prolonger le laps de temps de la mise en valeur de polarisation, lentement-détente états de spin nucléaires, dites d'état à long terme (LLS), peuvent être utilisés 15 -. 17 LLS sont insensibles à l'intra-paire dipôle-dipôle interaction, de sorte que leur temps de relaxation caractéristique constante, T LLS, peut être beaucoup plus longue que T 1. 18 Une durée de vie de l'aimantation de dizaines de minutes et jusqu'à 1 heure pourrait donc être obtenu, 19,20 et LLS ont été proposés à la fois pour la spectroscopie par résonance magnétique (SRM) et l'IRM. 21
Les principaux points qui doivent être soigneusement optimisée pour l'étude des taux de réaction enzymatique par hyperpolarisé RMN sont les suivants: (i) maximiser la polarisation à l'état solide et (ii) de minimiser la perte de polarisation pendant le transfert de la solution de la hyperpolarisépolariseur vers le spectromètre de RMN. Cet article décrit l'adaptation d'un système d'appareils et injection DNP dissolution sur mesure pour étudier les réactions enzymatiques. Les caractéristiques et les performances de l'installation seront démontrés avec le substrat hyperpolarisé bien connu et largement utilisé [1- 13 C] pyruvate. Les principales raisons de ce choix sont, en premier lieu, son naturellement longs 13 C temps de relaxation longitudinale (T 1> 50 secondes à des champs magnétiques élevés et des températures supérieures à 293 K) qui permet des réactions de surveillance pendant plusieurs minutes, et, d'autre part, son rôle central dans cancer métabolisme. 13,14 Utilisation dissolution DNP RMN et un système d'injection développé sur mesure, l'oxydation du pyruvate catalysée par la lactate déshydrogénase (LDH) peuvent être surveillés en présence d'un groupe initial de lactate non marqué 9,22 ou sans lactate ajoutée non marqué , comme montré ici. Il a été montré que le [1- 13 C] lactate de signal mesuré en vivo (y compris dans les cellules) après l'injection de hyperpolarisé [1- 13 C] pyruvate est principalement due à un échange d'étiquettes rapide entre pyruvate et lactate plutôt que de la production de lactate. 6
Nous présentons ici la production en temps réel de [1- 13 C] lactate à partir de pyruvate hyperpolarisé [1- 13C] injecté dans un tube de RMN LDH contenant initialement mais pas le lactate.
Description du système
Il y a deux parties principales dans une configuration dissolution de DNP (Figure 1): le polariseur de DNP et le spectromètre RMN. L'élément principal du polariseur DNP est un cryostat de refroidissement de l'échantillon à environ 1 K dans un bain d'hélium pompé. Le cryostat est inséré dans un aimant supraconducteur 3,35 T et a une géométrie qui garantit avoir l'échantillon de polarisation à l'isocentre de l'aimant (figure 1). À l'intérieur du cryostat, l'échantillon (a) est entouré par une bobine RMN (b), pour mesurer la polarisation buildup, contenu dans une cavité à micro-ondes overmoded (c). L'échantillon entier est maintenu à basse température dans un bain d'hélium pompé (d) et irradié avec des micro-ondes à travers le guide d'ondes. L'ensemble du système est géré par un logiciel sur mesure (figure 2D).
Le matériel et l'équipement cryogénique nécessaire pour effectuer DNP et la dissolution subséquente sont toujours un défi technologique. Un nouveau cryostat DNP 23,24 a été développé et testé pour déterminer ses performances cryogéniques et optimisée pour le refroidissement rapide, l'hélium hold-temps et la consommation globale d'hélium minimale pendant le fonctionnement.
Le cryostat est constitué de deux parties. La première partie du cryostat est le dewar d'isolation (figure 2A) qui peuvent être plus ou moins séparé dans la partie supérieure (a) la queue, ou de l'espace de l'échantillon (b), et de la chambre à vide externe (OVC) conservés sous vide poussé et le logement du écrans à rayonnement (c). La deuxième partie du cryostat est le principalSERT (figure 2B), placé dans le vase de Dewar d'isolation, où tous les règlements de flux sont gérés. L'hélium liquide provenant du Dewar de stockage externe à travers la ligne de transfert (a), est dans la première étape condensé dans le séparateur (b), une chambre intermédiaire utilisé à la fois pour maintenir la partie supérieure du froid cryostat et d'éliminer l'hélium évaporé pendant le transfert. La pression du séparateur est abaissée par pompage à travers un capillaire (c) enroulé autour de la partie supérieure du cryostat; le flux d'hélium froid dans ce capillaire est utilisée pour refroidir les déflecteurs (d) et les écrans de rayonnement dans le dewar d'isolation (OVC). L'échantillon est placé et polarisé dans l'espace d'échantillon. L'espace d'échantillon est connectée au séparateur via un autre tube capillaire (e), enroulé autour de la queue de l'insert principal cryostat. Ce capillaire peut être ouvert ou fermé par une soupape à pointeau actionnée manuellement de l'extérieur.
Pour atteindre la basse température utilisée au cours de la pr DNPocessus, hélium liquide doit être recueillie dans l'espace de l'échantillon de cryostat et sa pression abaissée à la gamme mbar. Les opérations nécessaires pour le fonctionnement du cryostat sont exécutées par un système de pompage assez complexes avec trois ensembles de pompes, contrôlées et gérées en différents points avec des instruments électroniques et électro-mécaniques (figure 2C). Le cryostat OVC doit être pompé à un vide poussé par le premier système de pompage. Ce système se compose d'une pompe turbomoléculaire soutenue par une pompe rotative (A). L'hélium liquide est transféré à partir du vase de Dewar de stockage (b) à travers l'entrée de transfert de cryostat de la ligne vers le séparateur de cryostat. Le séparateur comporte une sortie connectée au second groupe de pompage. Cet ensemble est composé d'un / h pompe 35 m 3 de membrane (c). Cette ligne permet l'évacuation du gaz d'hélium bouillie pendant le transfert à partir du vase de Dewar et au cours du refroidissement du séparateur. L'hélium liquide collecté dans le séparateur peut alors être transféré vers l'espace d'échantillon à travers le bouchonIllary tubes décrits ci-dessus. Pour transférer l'hélium liquide du séparateur à l'espace de l'échantillon et par la suite à la pression de l'espace de l'échantillon inférieure en mbar gamme, un troisième système de pompage composé d'un 250 m 3 / h Roots pompe soutenu par une / h pompe rotative 65 m 3 (d) est reliée à travers le cryostat une vanne papillon manuelle (e).
Toutes les opérations du système de vide sont contrôlés et régulés par un dispositif sur mesure électropneumatique (f). Cet appareil contrôle les connexions de la ligne de vide entre le séparateur de cryostat (g) et de l'espace d'échantillon (h) des points de vente, les deuxième, troisième systèmes / de pompage (C, D), une bouteille d'hélium comprimé (i) et l'extérieur. La communication entre (f) et l'extérieur passe à travers un clapet anti-retour (j). Le dispositif électro-pneumatique (f) ainsi que tous les paramètres du système et le matériel de dissolution sont contrôlés et exploités par un dispositif électronique USB interface avec un PC commun sur-mesure. Enfin tout le système, par l'électroniquedispositif, est géré par-mesure logiciel autonome (figure 2D) où les opérations concernées sont lancés à travers une interface en utilisant les boutons de logiciels.
Pour gérer l'échantillon et mesurer le signal RMN accumulation à l'état solide une série d'inserts sont utilisés (figure 3A). Pour préparer le cryostat pour une polarisation, placer l'échantillon principal insert (a), dans le cryostat. L'échantillon principal insert est muni d'une bobine RMN (b) placé à l'intérieur d'une cavité à micro-ondes doré overmoded. Pré-gel du substrat contenant la solution devant être polarisé (solution polarisation) à la température de l'azote liquide dans un récipient d'échantillon approprié et le placer à la partie inférieure du porte-échantillon de fibre de verre (c) d'extrémité. Faites glisser le porte-échantillon dans l'échantillon principal insert pour atteindre l'isocentre de l'aimant. Insérer le guide d'ondes plaqué or (d) dans le porte-échantillon. Le guide d'ondes micro-onde permet la généré à partir d'une source micro-onde externe de voyager avec des pertes minimes to l'échantillon.
Le logiciel sur mesure pour la gestion du cryostat gère automatiquement, lorsque vous cliquez sur le bouton de l'interface correspondante, différentes opérations comme temps de recharge (la température du cryostat est abaissée proche de la température de l'hélium liquide), de remplissage (le cryostat est rempli d'hélium liquide à un niveau prédéterminé ), une étape supplémentaire de refroidissement de 1 K T (le bain d'hélium liquide est pompé pour atteindre la température la plus basse possible), mise sous pression (le cryostat est mis sous pression légèrement supérieure à la pression ambiante à P = 10 à 30 mbar pour permettre cryostat ouverture sans risques de contamination du cryostat par l'air) et de la dissolution (procédure automatique pour dissoudre l'échantillon de DNP et transférer la solution résultante hyperpolarisé au site de mesure, à savoir le spectromètre RMN).
La polarisation est effectuée irradier l'échantillon avec un micro-ondes à 94 GHz (dans un champ de polarisation B 0 </sub> = 3.35 T). Un échantillon est considéré complètement polarisée après 3 T DNP, où T DNP est le temps de polarisation de l'accumulation. T DNP est du même ordre de grandeur que le temps de relaxation longitudinale des noyaux cibles à l'état solide sur le terrain et température donnée. Dans toutes nos expériences, l'échantillon a été polarisée pendant plus de 5 T DNP.
A la fin du temps de polarisation, l'échantillon doit être dissous dans une solution à température ambiante afin d'être utilisé pour la mesure de l'activité enzymatique. Au cours du processus de dissolution, 5 ml d'surchauffée D 2 O à partir de la chaudière de la plaquette de dissolution (figure 3B) sont poussés par comprimé de l'hélium gazeux (P = 8.6 bar) pour accéder à l'échantillon DNP améliorée et le dissoudre. La solution résultante hyperpolarisé est poussé hors de l'insert de dissolution par le gaz d'hélium comprimé, à travers la sortie d'insertion de la dissolution (figure 3C-b </strong>), un diamètre intérieur de tube de transfert de Teflon 2 mm. Le temps nécessaire pour le processus de dissolution est de 300 msec. 23 Le temps nécessaire pour le transfert de l'échantillon à partir du polariseur DNP sur le site du spectromètre RMN est d'environ 3 sec.
Le processus de dissolution est effectué en utilisant un insert de dissolution (figure 3B). L'insert de dissolution est composé d'un ensemble électronique-pneumatique (a), un bâton en fibres de carbone (b) contenant des tubes de raccordement entre la chaudière dans l'ensemble pneumatique et le casier de conteneurs d'échantillons (c), ce qui permet un couplage étanche avec l'échantillon récipient, et à l'arrière vers la sortie. L'ensemble électro-pneumatique (figure 3C) est utilisée pour produire et conduire surchauffée D 2 O à travers le bâtonnet de fibres de carbone pour le récipient d'échantillon, puis à extraire la solution hyperpolarisé à partir du cryostat. L'ensemble électro-pneumatique est composé de valves pneumatiques (a) et qui éliminent les liaisons entre le cohélium mpressed (P = 6-8 bar) ligne (b), la chaudière (c) où le D 2 O est injecté par la soupape (d), et la sortie (e) par le bâton de fibre de carbone (f). Le système est complété par un G à la pression, d'un thermomètre et d'un fil résistif de chauffage dans la chaudière (c), une gâchette (h) et une zone de raccordement (i) utilisé pour interfacer le système avec le dispositif de gestion électronique.
Le cryostat DNP et le spectromètre RMN sont reliés par une ligne de transfert, à savoir un tube en PTFE de 2 mm de diamètre interne à l'intérieur duquel la solution hyperpolarisé est poussé par de l'hélium sous pression (P = 8.6 bar) lorsque la dissolution est déclenchée.
La séquence de dissolution se compose des opérations suivantes: dans les 300 premières millisecondes, surchauffée D 2 O est poussé vers le récipient d'échantillon afin de faire fondre et dissoudre la solution congelée hyperpolarisé. Ensuite, la solution hyperpolarisé est extraite du cryostat par moyen de pressionsurized (P = 8.6 bar) de l'hélium gazeux et poussée à travers le tube en PTFE de diamètre intérieur de 2 mm (figure 3C-E) à l'endroit où la mesure où l'injection est réalisée avec l'un des modes opératoires décrits à l'étape 6.2.1 ou l'étape 6.2 .2.
Le deuxième volet de la dissolution configuration DNP RMN est le spectromètre RMN. Dans l'installation décrite ici, le spectromètre de RMN fonctionnant à un champ B 0 = 11,7 Tesla. Une sonde de RMN de 5 mm est utilisé pour mesurer le signal hyperpolarisé après la dissolution. Le spectromètre de RMN est exploité par la console RMN, utilisé à la fois à l'état solide et l'état liquide mesures de RMN et le XWINNMR logiciel cabinet fourni. Une mesure typique se compose d'une impulsion forte à faible angle de basculement (soit calibré, pour liquidstate ou non-étalonné, pour les mesures à l'état solide), suivie par les acquisitions de signal.
Mesures du signal de polarisation thermique à l'état solide et si DNP dérivésgnal accumulation sont effectuées à l'aide de la bobine sur mesure 13 C au niveau du site du polariseur DNP (figure 3AB) couplé au spectromètre RMN. Dans ce cas particulier, le spectromètre RMN ne réalise pas de verrouillage de signal. Lorsque les mesures à l'état solide sont réalisées, afin d'éviter des perturbations importantes à la polarisation, le temps de retard entre les acquisitions doit être suffisamment long, à peu près plus de 0,5 T DNP.
La mise en valeur à l'état solide est définie comme 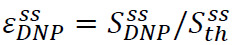 où
où ![]() est le signal hyperpolarisé (obtenu à l'étape 3.3) et
est le signal hyperpolarisé (obtenu à l'étape 3.3) et ![]() le signal est à l'état solide (obtenu à l'équilibre thermique à la température de l'hélium liquide pompé à l'étape 3.2) (figure 4A). Ce paramètre defines la polarisation maximale disponible pour les expériences de RMN, avant pertes inévitables lors du transfert de la solution hyperpolarisé. La mesure est effectuée avec une séquence d'impulsions acquérir simple en utilisant une impulsion d'angle faible bascule non-étalonné. calibration d'impulsion est généralement ignorée pour les mesures SolidState.
le signal est à l'état solide (obtenu à l'équilibre thermique à la température de l'hélium liquide pompé à l'étape 3.2) (figure 4A). Ce paramètre defines la polarisation maximale disponible pour les expériences de RMN, avant pertes inévitables lors du transfert de la solution hyperpolarisé. La mesure est effectuée avec une séquence d'impulsions acquérir simple en utilisant une impulsion d'angle faible bascule non-étalonné. calibration d'impulsion est généralement ignorée pour les mesures SolidState.
Une procédure analogue peut être utilisé pour déterminer l'amplification du signal hyperpolarisé à l'état liquide. Dans ce cas, l'échantillon placé dans le tube de spectromètre avant l'injection (étape 6.2) est composé de 500 ul de D 2 O. Après dissolution et d'injection, il existe deux paramètres importants à surveiller. La première est le renforcement hyperpolarisé au site de spectromètre RMN, 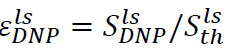 (Figure 4B), où
(Figure 4B), où ![]() est le signal juste après l'injection de l'hyper solution polarisée (obtenu à l'étape 7.1) et
est le signal juste après l'injection de l'hyper solution polarisée (obtenu à l'étape 7.1) et ![]() est le signal de polarisation thermique (obtenu à l'étape 7.2). Le second est le temps de relaxation longitudinale T 1 (Figure 4B, encadré), associée avec le substrat et chaque produit métabolique (obtenus par des signaux d'ajustement exponentielle obtenue à l'étape 7.1). Ces deux paramètres définissent la concentration minimale de substrat nécessaire pour obtenir un rapport suffisant signal sur bruit (SNR) et la fenêtre de temps disponible pour la mesure des transformations métaboliques. Le rapport entre la polarisation à l'état solide
est le signal de polarisation thermique (obtenu à l'étape 7.2). Le second est le temps de relaxation longitudinale T 1 (Figure 4B, encadré), associée avec le substrat et chaque produit métabolique (obtenus par des signaux d'ajustement exponentielle obtenue à l'étape 7.1). Ces deux paramètres définissent la concentration minimale de substrat nécessaire pour obtenir un rapport suffisant signal sur bruit (SNR) et la fenêtre de temps disponible pour la mesure des transformations métaboliques. Le rapport entre la polarisation à l'état solide ![]() et la polarisation liquidstate
et la polarisation liquidstate ![]() donne une estimation des pertes de polarisation dues à la relaxation pendant le transfert de solution hyperpolarisé. Une valeuration12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "/> devrait être observée en l'absence de pertes de relaxation.
donne une estimation des pertes de polarisation dues à la relaxation pendant le transfert de solution hyperpolarisé. Une valeuration12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "/> devrait être observée en l'absence de pertes de relaxation.
Protocol
Representative Results
Discussion
Les points critiques de la dissolution expérience DNP RMN sont les suivants: (i) le niveau de polarisation atteint pour le substrat, qui détermine la concentration du produit la plus faible nécessaire pour des expériences ainsi que le nombre d'acquisitions de signaux qui peuvent être effectuées et (ii) la durée de vie d'aimantation, par rapport à la durée du transfert de la polarisation et les sites de détection et de la vitesse de transformation du substrat. Le système d'injection de l'instal…
Declarações
The authors have nothing to disclose.
Acknowledgements
Les auteurs remercient le Dr JJ van der Klink pour l'assistance dans le choix et l'assemblage de l'équipement, ainsi que le Dr F. Kateb et le Dr G. Bertho pour des discussions utiles. AC a été soutenu par le Fonds national suisse (accorder PPOOP2_157547). Nous reconnaissons financement de Paris Sorbonne Cité (RMN @ Com, DIM Analytics, Ville de Paris, la Fondation de la Recherche Médicale (FRM ING20130526708), et l'Parteneriat Hubert Curien Brancusi 32662QK. Notre équipe fait partie des programmes Equipex Paris-en résonance et CACSICE.
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
Referências
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

