Die Auflösung dynamische Kernpolarisation Besetzung für Echtzeit-enzymatische Reaktionsgeschwindigkeit Messungen von NMR
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
Die wichtigste Einschränkung der NMR-basierten Untersuchungen ist niedriger Empfindlichkeit. Dies fordert für lange Aufnahmezeiten, also in Echtzeit NMR-Messungen von Stoffwechselumwandlungen zu verhindern. Hyperpolarisation über Auflösung DNP umgeht Teil der Empfindlichkeit gibt dank der großen Out-of-Gleichgewicht Kernmagnetisierungs aus dem Assoziierungsabkommen Elektron-zu-Kern-Spin Polarisationstransfer. Die hohe NMR-Signal erhalten werden, können chemische Reaktionen in Echtzeit zu überwachen. Die Kehrseite der hyperpolarisierten NMR liegt in der begrenzten Zeitfenster für die Signalerfassung, die in der Regel in Längsrichtung in der Größenordnung des Kernspins ist Relaxationszeit, T 1, oder, in günstigen Fällen in der Größenordnung des konstanten Relaxationszeit im Zusammenhang mit der Singulett-Zustand gekoppelt Kerne, T LLS. Die zelluläre Aufnahme von körpereigenen Molekülen und Stoffwechselraten können wichtige Informationen auf die Tumorentwicklung und Drogen Antwort liefern. Numerous vorherigen hyperpolarisierten NMR-Untersuchungen haben zur Überwachung der enzymatischen Aktivität in vivo die Relevanz von Pyruvat als metabolisches Substrat demonstriert. Diese Arbeit enthält eine detaillierte Beschreibung des experimentellen Aufbaus und Verfahren zur Untersuchung von enzymatischen Reaktionen erforderlich, um insbesondere die Pyruvat zu Lactat Umwandlungsrate in Gegenwart von Lactatdehydrogenase (LDH), die von hyperpolarisierten NMR.
Introduction
Dynamische Kernpolarisation (DNP), 1,2 eine Technik entwickelt, um die Kernspinpolarisation zu erhöhen, das heißt, das Ungleichgewicht zwischen "oben" und "unten" Spinpopulationen (P = [N ↑ – N ↓] / [N ↑ + N ↓]), wurde zum ersten Mal in den 1950er Jahren eingeführt. Kernspins wie 13 C bis zu P = 10 -1 unter günstigen Bedingungen polarisiert werden, typischerweise bei einer Temperatur in der Größenordnung von 1 K und in einem Magnetfeld von 3,357 T. 3,4 ein Durchbruch für biologische Anwendungen kamen in der frühen 2000er Jahren mit der Entwicklung von Lösungs DNP, die bei der Auflösung von gefrorenen polarisierten Proben in überhitztem Wasser besteht, während die hohe Kernpolarisation Ebene bei niedriger Temperatur erhalten Halte. 5 die Flüssigkeit-NMR-Signal um einen Faktor 10 3 -10 4 verstärkt wird im Vergleich zu verbreitetRT NMR Bedingungen thermisch polarisiert. Dissolution DNP ist daher ein Weg, um nicht-invasiv messen biochemischen Reaktionsgeschwindigkeiten in situ in Echtzeit, so dass die Überwachung Dynamik durch NMR mit einer zeitlichen Auflösung von 1 s oder weniger. 6 – 10 wurde es möglich, auch sehr geringe Konzentrationen von Analyten in erkennen 11.
Unter den nicht-invasive Bildgebungsverfahren Molekül ist hyperpolarisierten NMR die einzige Technik, die ein Substrat und seine Stoffwechselprodukte in Echtzeit gleichzeitige Messung ermöglicht. Dissolution DNP mit Enthusiasmus in verschiedenen wissenschaftlichen Bereichen empfangen wurde im Bereich von in vitro NMR zu klinischen MRI 12 und den vielversprechendsten Anwendungen der in situ verbunden sind Überwachung des Stoffwechsels. 13,14 Die Hauptbegrenzung der Auflösung DNP ist, dass nach einer Zeit auf die Reihenfolge der fünffachen Längs Relaxationszeitkonstante T 1, das polare verbesserterung verloren. Kernspins Lager ausstellenden relativ lange T 1 ist es daher notwendig, Moleküle zu verwenden. Um die Zeitspanne des Polarisationsverstärkung erstrecken, langsam entspannende Kernspinzuständen, bekannt als langlebige Zustände (LLS), verwendet werden. 15 – 17 LLS sind unempfindlich gegenüber der intra-Paar Dipol-Dipol-Wechselwirkung, so dass ihre charakteristische Relaxationszeit, T LLS kann als T 1 viel länger sein. 18 eine Magnetisierungs Lebensdauer von zehn Minuten bis zu 1 Stunde daher erhalten werden konnte, 19,20 und LLS wurden sowohl für magnetische Resonanzspektroskopie (MRS) vorgeschlagenen und MRT. 21
Die wichtigsten Punkte, die für das Studium enzymatische Reaktionsgeschwindigkeiten von hyperpolarisierten NMR sind sorgfältig optimiert werden müssen: (i) maximieren die Solid-State-Polarisation und (ii) die Polarisationsverlust während der Übertragung des hyperpolarisierten Lösung aus der minimierenPolarisator zur NMR-Spektrometer. Dieser Artikel beschreibt die Anpassung eines maßgeschneiderten Auflösung DNP Gerät und Einspritzsystem enzymatischen Reaktionen zu untersuchen. Die Eigenschaften und die Leistung der Einrichtung wird mit der bekannten und weit verbreiteten hyperpolarisiertem Substrat [1- 13 C] Pyruvat nachgewiesen werden. Die Hauptgründe für diese Entscheidung sind erstens seine natürlich lange 13 C longitudinale Relaxationszeit (T 1> 50 sec bei hohen Magnetfeldern und Temperaturen über 293 K), die Überwachung Reaktionen während mehrerer Minuten erlaubt, und zweitens, ihre zentrale Rolle in Krebsstoffwechsel. 13,14 mit Auflösung DNP-NMR und eine kundenspezifisch entwickelte Einspritzsystem, um die Oxidation von Pyruvat durch Laktat-Dehydrogenase (LDH) katalysiert wird, kann in Gegenwart eines anfänglichen Pool von unmarkierten Laktat 9,22 oder ohne unmarkierte Laktat überwacht werden hinzugefügt , wie hier gezeigt. Es hat sich gezeigt, dass die [1- 13 C] Laktat Signal in vi gemessenvo (einschließlich in Zellen) nach der Injektion von hyperpolarisiertem [1- 13 C] Pyruvat ist vor allem auf eine schnelle Etikettenaustausch zwischen Pyruvat und Lactat anstatt Laktatproduktion. 6
Wir präsentieren hier die Echtzeit-Produktion von [1- 13 C] Laktat von hyperpolarisierten [1- 13 C] Pyruvat in einem NMR-Röhrchen eingespritzt LDH, jedoch zunächst ohne Laktat.
Systembeschreibung
Es gibt zwei Hauptteile in einem Löse DNP setup (Abbildung 1): Die DNP Polarisator und dem NMR-Spektrometer. Das Hauptelement des DNP Polarisator ist ein Kryostat die Probe um 1 K in einem Pump Heliumbad zu kühlen. Der Kryostat ist in einem 3,35 T supraleitenden Magneten eingesetzt und hat eine Geometrie, die die Polarisations Probe im Isozentrum des Magneten (1) zu haben, sicherstellt. Im Innern des Kryostaten wird die Probe (a) durch eine NMR-Spule (b), umgeben die Polarisation b zu messenuildup, enthalten in einer übermodierten Mikrowellenkavität (c). Die gesamte Probe wird bei niedriger Temperatur in einem Pump Heliumbad (d) und Bestrahlung mit Mikrowellen durch den Wellenleiter gehalten wird. Das gesamte System wird durch maßgeschneiderte Software (2D) verwaltet.
Die Hardware und die Tieftemperatur-Ausrüstung benötigt DNP und die anschließende Auflösung durchzuführen, sind nach wie vor eine technologische Herausforderung. Eine neue DNP Kryostaten 23,24 wurde entwickelt und getestet, um seine Tieftemperatur Leistungen zu bestimmen und dann für eine schnelle Abkühlung, Helium Haltezeit und insgesamt noch geringen Heliumverbrauch im Betrieb optimiert.
Der Kryostat besteht aus zwei Teilen. Der erste Teil des Kryostaten ist die Isolierung Dewar (2A), die in etwa in Oberteil getrennt werden kann (a) der Schwanz oder Probenraum (b), und die äußere Vakuumkammer (OVC) im Hochvakuum und Gehäuse gehalten dem Strahlungsschirme (c). Der zweite Teil des Kryostaten ist der Haupt insert (2B), in die Isolierung Dewar platziert, wo alle Wasserregelung gesteuert werden. Das flüssige Helium aus der externen Speicher Dewar durch die Leitung übertragen sind (a), in der ersten Stufe in den Separator (B) kondensiert ist, verwendet eine Zwischenkammer sowohl den oberen Teil des Kryostaten kalt zu halten und die Helium verdampft zu entfernen bei der Übergabe. Der Separator Druck wird um den oberen Teil des Kryostaten gewickelt abgesenkt durch Pumpen durch eine Kapillare (c); der Fluss des kalten Helium in dieser Kapillare werden die Leitbleche (d) und der Strahlungsschirme in der Isolations Dewar (OVC) abkühlen. Die Probe wird angeordnet und polarisiert in den Probenraum. Der Probenraum ist mit dem Separator durch eine andere Kapillare (e) verbunden ist, um den Schwanz des Haupt Kryostaten Einsatz gewickelt. Diese Kapillare kann durch ein Nadelventil manuell von außen betätigt geöffnet oder geschlossen werden.
die niedrige Temperatur während der DNP pr verwendet zu erreichenocess muss flüssiges Helium in den Kryostaten Probenraum gesammelt werden und der Druck auf den mbar Bereich abgesenkt. Die Operationen für Kryostaten Betrieb notwendig sind über einen ziemlich komplexen Pumpensystems mit drei Sätzen von Pumpen durchgeführt, überwacht und in verschiedenen Punkten mit elektronischen und elektromechanischen Instrumente (2C) betrieben. Der Kryostat OVC muss durch den ersten Pumpsystem zu Hochvakuum gepumpt werden. Dieses System besteht aus einer Turbomolekularpumpe bestehend aus einer Kreiselpumpe (a) gesichert. Das flüssige Helium wird von der Speicher Dewar (b) durch die Transferleitung Kryostaten Einlass zu dem Kryostaten Separator überführt. Der Separator hat einen Zugang zum zweiten Pumpenaggregat angeschlossen. Dieses Set besteht aus einer Pumpe 35 m 3 / h Membran besteht (c). Diese Linie ermöglicht das Entfernen der Heliumgas während der Übertragung aus dem Dewar und bei Trennkühlung gekocht. Das flüssige Helium im Abscheider kann dann an den Probenraum durch die Kappe übertragen werdenIllary Rohre oben beschrieben. Zur Übertragung von flüssigem Helium aus dem Abscheider in den Raum Probe und anschließend auf niedrigere Probenraum Druck auf mbar Bereich, ein System dritte Pump bestehend aus einem 250 m 3 / h Rootspumpe durch eine 65 m 3 / h Kreiselpumpe (d) gesichert ist mit dem Kryostaten durch eine manuelle Drosselventil (e).
Alle Vakuumsystemoperationen gesteuert und geregelt durch eine elektropneumatische Sonderanfertigung (f). Dieses Gerät steuert Vakuumleitungsverbindungen zwischen dem Kryostaten Separator (g) und Probenraum (h) Verkaufsstellen, die zweite / dritte Pumpsysteme (c, d), eine komprimierte Heliumflasche (i) und der Außenseite. Die Kommunikation zwischen (f) und der Außenseite durchläuft ein Einwegventil (j). Der elektro-pneumatische Einrichtung (f) sowie alle Systemparameter und die Auflösung Hardware sind durch eine maßgeschneiderte elektronische Gerät angeschlossen USB mit einem handelsüblichen PC gesteuert und betrieben. Schließlich alle das System, durch das elektronischeGerät wird durch maßgeschneiderte Standalone-Software (2D) verwaltet gegebenenfalls Operationen über eine Schnittstelle ins Leben gerufen werden Software-Tasten.
Um die Probe zu verwalten und zu messen NMR-Signal Aufbau im Festkörper eine Reihe von Einsätzen verwendet werden (3A). Um den Kryostaten für Polarisation vorzubereiten, legen Sie die Hauptprobeneinsatz (a), in den Kryostaten. Der Hauptprobeneinsatz im Inneren eines übermodierten vergoldet Mikrowellenhohlraum gegeben, der mit einem NMR-Spule (b) zur Verfügung gestellt. Vor dem Einfrieren der Substratlösung, die in einem geeigneten Probenbehälter bei Temperatur von flüssigem Stickstoff polarisiert (Polarisations Lösung) zu werden, und es am Ende Unterseite des Glasfaserprobenhalter (c) platzieren. Schieben Sie den Probenhalter in die Hauptprobeneinsatz zu den Magneten Isozentrum erreichen. Legen Sie die vergoldet Wellenleiter (d) in den Probenhalter. Der Wellenleiter kann der Mikrowelle von einer externen Mikrowellenquelle erzeugt mit minimalen Verlusten t zu reiseno die Probe.
Maßgeschneiderte Software für Kryostaten Management kümmert sich automatisch um, nach dem Klicken auf die entsprechende Schnittstelle Taste, verschiedene Operationen wie Abklingzeit (der Kryostat Temperatur Temperatur von flüssigem Helium nahe gesenkt wird), Füllung (der Kryostat mit flüssigem Helium auf einen vorbestimmten Pegel gefüllt ist ) ein zusätzlicher Schritt zu T 1 ≈ K (das flüssige Heliumbad gepumpt der Kühlung zu erreichen ist die niedrigste Temperatur möglich), Unterdrucksetzen (der Kryostat etwas über Raumdruck bei unter Druck P = 10-30 mbar Kryostaten Öffnung ohne Risiken zu ermöglichen, der Verschmutzung des Kryostaten durch die Luft) und Auflösung (automatisches Verfahren die DNP Probe und gibt das resultierende hyperpolarisierten Lösung Meßort, das heißt die NMR-Spektrometer) aufzulösen.
Die Polarisation wird durchgeführt, bei 94 GHz, die Probe mit Mikrowellen bestrahlt wird (in einem Polarisationsfeld B 0 </sub> = 3,35 T). Eine Patientenprobe gilt als vollständig polarisiert nach 3 T DNP, wobei T DNP ist die Polarisation Aufbauzeit. T DNP der gleichen Größenordnung ist als die longitudinale Relaxationszeit der Zielkerne im festen Zustand bei dem betreffenden Bereich und Temperatur. In allen Experimenten wurde die Probe für mehr als 5 T DNP polarisiert.
Am Ende der Polarisationszeit muss die Probe in einer RT-Lösung, um aufgelöst zu werden, um für die Messung der Enzymaktivität verwendet werden. Während des Auflösungsprozesses, 5 ml von überhitztem D 2 O aus dem Kessel der Auflösung Einsatz (3B) durch komprimierte Heliumgas geschoben (P = 6-8 bar), um die DNP-verstärkten Probe zu erreichen und es aufzulösen. Das resultierende hyperpolarisierten Lösung wird die Auflösung Einsatz durch die komprimierte Heliumgas ausgestoßen, durch die Auflösung Einsatz Steckdose (3C-b </strong>), einem 2 mm Innendurchmesser Teflon Rohrweiche. Die Zeit für den Auflösevorgang benötigt wird, ist 300 msec. 23 die Zeit für den Probentransfer von der benötigten DNP Polarisator zum Aufstellungsort NMR Spektrometer beträgt etwa 3 sec.
Der Lösevorgang wird durchgeführt, eine Auflösungs Einsatz (3B) verwenden. Die Auflösung Einsatz besteht aus einem elektronischen pneumatischen Baugruppe (a) eine Kohlenstofffaser-Stick (b) Verbindungsrohre zwischen dem Kessel in die pneumatische Anordnung und dem Probenbehälter Schließfach (c) enthält, die mit der Probe dichte Kopplung ermöglicht out zum Auslass Behälter und zurück. Die elektropneumatischen Baugruppe (3C) verwendet überhitzten D 2 O durch die Kohlefaserstab zu dem Probenbehälter zu erzeugen und fahren und dann die hyperpolarisierte Lösung aus dem Kryostaten zu extrahieren. Der elektropneumatische Baugruppe wird von Pneumatikventilen (a) zusammengesetzt, die die Verbindungen zwischen der CO-Regelungmpressed Helium (P = 6-8 bar) Linie (b), der Kessel (c), wo die D 2 O durch das Ventil (d) eingespritzt wird, und der Ausgang (e) durch die Kohlenstofffaser-Stick (f). Das System wird durch einen Druck G, einem Thermometer und einem Wärmewiderstandsdraht in dem Kessel (c), einem Abzug (h) und einem Anschlusskasten (i) verwendet, um eine Schnittstelle, das System mit dem elektronischen Verwaltungsvorrichtung abgeschlossen.
Die DNP Kryostaten und das NMR-Spektrometer sind durch eine Transferleitung, dh eine PTFE-Röhre von 2 mm Innendurchmesser innerhalb dessen das hyperpolarisierte Lösung durch unter Druck stehende Helium (P = 6-8 bar) gedrückt wird verbunden, wenn die Auflösung ausgelöst wird.
Die Auflösung Sequenz besteht aus den folgenden Operationen besteht: in den ersten 300 ms, überhitztem D 2 O wird zu dem Probenbehälter geschoben, um das hyperpolarisierte gefrorenen Lösung zu schmelzen und aufzulösen. Danach wird das hyperpolarisierte Lösung aus dem Kryostaten durch Mittel der pres extrahiertensurized (P = 6-8 bar) Heliumgas und schob durch die 2 mm Innendurchmesser PTFE-Schlauch (3C-E) an die Messstelle an der Injektionsstelle mit einem der Verfahren beschrieben in Schritt durchgeführt wird, 6.2.1 oder 6.2 Schritt 0,2.
Die zweite Komponente des Lösungs DNP-NMR-Einrichtung ist das NMR-Spektrometer. Im Setup hier beschrieben ist, arbeitet der NMR-Spektrometer bei einer Feld B 0 = 11,7 Tesla. Ein 5 mm NMR-Sonde wird verwendet, um das hyperpolarisierte Signal nach der Auflösung zu messen. Die NMR-Spektrometers wird durch die NMR-Konsole bedient, für verwendet, um sowohl Festkörper- und Flüssig-NMR-Messungen und die Firma bereitgestellte Software xwinnmr. Eine typische Messung eines niedrigen Kippwinkel harten Puls besteht (entweder kalibriert, für liquidstate oder unkalibrierten, für Solid-State-Messungen) durch Signalübernahmen verfolgt.
Messungen des Festkörperwärmepolarisationssignal und DNP-derived signal Aufbau werden unter Verwendung des maßgeschneiderten durchgeführt 13 C-Spule an der Stelle des DNP Polarisator (Abbildung 3Ab), die mit der NMR-Spektrometer. In dieser besonderen Situation führen die NMR-Spektrometer Signal Verriegelungs nicht. Wenn Festkörper-Messungen durchgeführt werden, um zu verhindern signifikante Störungen der Polarisation, sollte die Zeitverzögerung zwischen Akquisitionen lang genug sein, etwa mehr als 0,5 T DNP.
Die Solid-State-Erweiterung ist definiert als 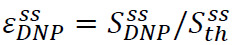 woher
woher ![]() wird das hyperpolarisierte Signal (in Schritt 3.3 erhalten) und
wird das hyperpolarisierte Signal (in Schritt 3.3 erhalten) und ![]() ist die Festkörpersignal (4A) (im thermischen Gleichgewicht bei gepumpt Temperatur von flüssigem Helium in Schritt 3.2 erhalten). Dieser Parameter ddefiniert den maximalen Polarisation für NMR-Experimente zur Verfügung, vor unvermeidlichen Verluste während der Übertragung des hyperpolarisierten Lösung. Die Messung wird mit einem einfachen Puls-acquire Reihenfolge ausgeführt, um eine nicht-abgeglichenen geringen Kippwinkel Puls verwenden. Pulse Kalibrierung wird für Festkörpermessungen häufig übersprungen.
ist die Festkörpersignal (4A) (im thermischen Gleichgewicht bei gepumpt Temperatur von flüssigem Helium in Schritt 3.2 erhalten). Dieser Parameter ddefiniert den maximalen Polarisation für NMR-Experimente zur Verfügung, vor unvermeidlichen Verluste während der Übertragung des hyperpolarisierten Lösung. Die Messung wird mit einem einfachen Puls-acquire Reihenfolge ausgeführt, um eine nicht-abgeglichenen geringen Kippwinkel Puls verwenden. Pulse Kalibrierung wird für Festkörpermessungen häufig übersprungen.
Eine analoge Vorgehensweise kann das hyperpolarisierte Signalverstärkung in den flüssigen Zustand zu bestimmen. In diesem Fall wird die in dem Spektrometerrohr platziert Probe vor der Injektion (Schritt 6.2) besteht aus 500 & mgr; l von D 2 O. Nach dem Auflösen und Injektion, gibt es zwei wichtige Parameter zu überwachen. Das erste ist das hyperpolarisierte Enhancement im NMR-Spektrometer Ort, 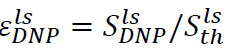 (4B), wobei
(4B), wobei ![]() ist das Signal direkt nach dem Einspritzen des hyper polarisiert Lösung (erhalten in Schritt 7.1) und
ist das Signal direkt nach dem Einspritzen des hyper polarisiert Lösung (erhalten in Schritt 7.1) und ![]() ist die thermische Polarisationssignal (im Schritt 7.2 erhalten). Die zweite ist die longitudinale Relaxationszeit, T 1 (4B, Einschub), verbunden mit dem Substrat und jede Stoffwechselprodukt (erhalten durch exponentielle Anpassung Signale, erhalten in Schritt 7.1). Diese beiden Parameter definieren die minimale Substratkonzentration erforderlich, um eine ausreichende Signal-Rausch-Verhältnis (SNR) und der verfügbaren Zeitfenster zur Messung der metabolischen Umwandlungen zu erhalten. Das Verhältnis zwischen Festkörper Polarisation
ist die thermische Polarisationssignal (im Schritt 7.2 erhalten). Die zweite ist die longitudinale Relaxationszeit, T 1 (4B, Einschub), verbunden mit dem Substrat und jede Stoffwechselprodukt (erhalten durch exponentielle Anpassung Signale, erhalten in Schritt 7.1). Diese beiden Parameter definieren die minimale Substratkonzentration erforderlich, um eine ausreichende Signal-Rausch-Verhältnis (SNR) und der verfügbaren Zeitfenster zur Messung der metabolischen Umwandlungen zu erhalten. Das Verhältnis zwischen Festkörper Polarisation ![]() und liquidstate Polarisation
und liquidstate Polarisation ![]() gibt bei der hyperpolarisierten Lösung Übertragung einer Schätzung der Polarisationsverluste aufgrund Entspannung. Ein Wertation12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "/> sollten in Abwesenheit der Entspannung Verluste beobachtet werden.
gibt bei der hyperpolarisierten Lösung Übertragung einer Schätzung der Polarisationsverluste aufgrund Entspannung. Ein Wertation12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "/> sollten in Abwesenheit der Entspannung Verluste beobachtet werden.
Protocol
Representative Results
Discussion
Die kritischen Punkte der Auflösung DNP-NMR-Experiment sind: (i) das Niveau der Polarisation für das Substrat erreicht, das die niedrigste Produktkonzentration, die für Experimente sowie die Anzahl der Signalnahmen bestimmt, die durchgeführt werden können, und (ii) die Lebensdauern der Magnetisierung auf die Dauer der Übertragung zwischen der Polarisation und der Detektionsorte und auf die Geschwindigkeit der Substrat Transformation verglichen. Das Einspritzsystem der DNP-Setup Auflösung hierin ermöglicht in wen…
Declarações
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Dr. JJ van der Klink für die Unterstützung bei der Auswahl und Montage der Ausrüstung, sowie Dr. F. Kateb und Dr. G. Bertho für nützliche Diskussionen. AC wurde von der Swiss National Science Foundation (Grant PPOOP2_157547) unterstützt. Wir erkennen Finanzierung von Paris Sorbonne Cité (NMR @ Com, DIM Analytics, Ville de Paris, der Fondation de la Recherche Médicale (FRM ING20130526708) und der Parteneriat Hubert Curien Brancusi 32662QK. Unser Team ist Teil Equipex Programme Paris-en-Resonanz und CACSICE.
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
Referências
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

