マウス肺切除術および義歯移植による内臓肺表面積の標準化法
Summary
内臓の肺表面積(ISA)は、肺疾患および傷害誘発性肺胞再生における肺の形態学および生理学を評価するための決定的な基準である。ここでは、肺の肺切除術とプロテーゼ移植マウスモデルの両方でISAの測定バイアスを最小限に抑える標準化された方法について説明します。
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
肺の基本的機能は、血管と大気との間の酸素と二酸化炭素の交換である。気管支肺胞形成異常(BPD)、慢性閉塞性肺疾患(COPD)、急性呼吸器感染症などの肺疾患は、ISA 2の減少をもたらす。肺疾患を研究研究者はMLI、ILV、ガス交換ユニットの数、ISA、および肺組織のコンプライアンス2、3などの肺の形態学的変化を評価するためにいくつかの定量的な方法を開発しました。 Weibel らによる先駆的研究4およびDuguid ら 5一緒にISAは、ヒト肺における肺のガス交換能力の直接の尺度として使用することができ、肺気腫の重症度を決定するための基準として使用することができることを確立しました。過去5年間に発表された多くの研究では、肺の形態学的パラメーター( 例えば、 </e開発6中や傷害PNX 1、7から回復中のマウスの肺の形態学的および機能的変化を評価するために、M> ISAとMLI)。 ISAは、 式(1)8,9用いて計算されます。
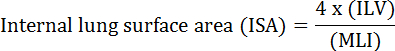
ここで、ILVは、内部肺容積であり、MLIは、肺周辺空隙サイズ10を表す中間パラメータである。
PNX、一つ以上の肺葉の外科的切除は、広く人間11、マウス1、犬12、ラット13、およびウサギ14、15を含め、多くの種で、肺胞の再生を誘導することが報告されています。スタッドPNX後14日目にマウスの肺のyは、既存の肺胞の拡大と肺胞の新形成の両方が、残りの肺組織におけるISA、ILV、および肺胞の数の回復に寄与することを示した1 。我々と他の人は、スポンジ、ワックス、カスタム形状のプロテーゼなどの材料を空の胸腔にPNX( すなわち人工器官の植え込み)後に挿入すると、肺胞の再生が損なわれることを示しています。今ではしっかりと肺胞の再生1、16、17を開始するための最も重要な要因の一つとして、その機械的な力の機能を確立しています。そのような研究は、肺胞再生を定量的に評価する基準として、PNX処置および人工器官埋め込み肺からのISA値を使用する有効性を強調している。
観察者バイアスは、測定されたvaに有意に影響を及ぼすことが知られている肺の形態学的パラメーター( 例えば 、MILおよびILV)についてのルーツ。 ISAの計算に使用される2つのパラメータであるILVとMLIの両方を決定する際に、標準化されたプロトコルを使用してこのバイアスを回避することができます。ここでは、これらの肺パラメータを測定するための非常に詳細な、標準化されたプロトコルを提供します。重要なことに、ISAを正確に定量する能力は、損傷誘発性の肺胞再生モデルにおける肺機能の研究の信頼性および再現性を改善することを約束し、複数の肺疾患における機械的発見を促進するはずである。
Protocol
Representative Results
Discussion
このプロトコールでは、マウス左肺PNXおよび人工器官移植後の肺パラメータの測定についての詳細な説明を提供する。 ISAは現在、多くの肺疾患および傷害誘発性肺胞再生における呼吸機能の評価のための重要なメトリックであると考えられている。しかし、肺研究の共同体はISAの有用性について有用な指標として合意されているが、ISAを計算するために使用されるILVとMLIの測定の標準化につ…
Declarações
The authors have nothing to disclose.
Acknowledgements
著者は北京生物科学研究所に支援を求めています。この研究は、北京市自然科学財団(No Z17110200040000)の支援を受けました。
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referências
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

