Um Método Padronizado para Medição da Superfície de Pulmão Interna via Neumonectomia de Mouse e Implante de Prótese
Summary
A área de superfície pulmonar interna (ISA) é um critério crítico para avaliar a morfologia pulmonar e a fisiologia em doenças pulmonares e regeneração alveolar induzida por lesão. Descrevemos aqui um método padronizado que pode minimizar o viés de medição para ISA tanto na pneumonectomia pulmonar quanto nos modelos de mouse de implante de prótese.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
A função fundamental do pulmão é a troca de oxigênio e dióxido de carbono entre os vasos sanguíneos e a atmosfera. As doenças pulmonares como a displasia broncopulmonar (DBP), a doença pulmonar obstrutiva crônica (DPOC) e as infecções respiratórias agudas resultam em diminuição da AIS 2 . Pesquisadores que estudaram doença pulmonar desenvolveram vários métodos quantitativos para avaliar alterações morfológicas nos pulmões, incluindo MLI, ILV, número de unidades de troca de gás, ISA e adesão ao tecido pulmonar 2 , 3 . Estudos pioneiros de Weibel et al. 4 e Duguid et al. 5 juntos estabeleceram que o ISA pode ser usado como uma medida direta da capacidade de troca de gás pulmonar em pulmões humanos e pode ser usado como critério para determinar a gravidade do enfisema. Uma série de estudos publicados nos últimos cinco anos utilizaram parâmetros morfológicos pulmonares ( por exemplo, </eM> ISA e MLI) para avaliar mudanças morfológicas e funcionais nos pulmões de camundongos durante o desenvolvimento 6 e durante a recuperação da lesão PNX 1 , 7 . O ISA é calculado usando a Equação 1 8 , 9 :
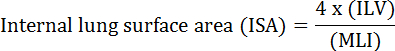
, Onde ILV é o volume pulmonar interno e MLI é um parâmetro intermediário que representa o espaço aéreo periférico do espaço 10 .
A PNX, a remoção cirúrgica de um ou mais lóbulos pulmonares, foi amplamente relatada para induzir regeneração alveolar em muitas espécies, incluindo humanos 11 , camundongos 1 , cães 12 , ratos 13 e coelhos 14 , 15 . Um galinheiroDos pulmões de ratos aos catorze dias pós-PNX mostraram que tanto a expansão dos alvéolos pré-existentes como a formação de novo de alvéolos contribuem para a restauração de ISA, ILV e o número de alvéolos nos demais tecidos pulmonares 1 . Nós e outros mostraram que a inserção de materiais como esponja, cera ou uma prótese em forma de costume na cavidade torácica vazia após PNX ( ou seja , implantação de prótese) prejudica a regeneração alveolar. Agora está firmemente estabelecido que a força mecânica funciona como um dos fatores mais importantes para iniciar a regeneração alveolar 1 , 16 , 17 . Tais estudos evidenciaram a eficácia do uso de valores ISA de pulmões tratados com PNX e Prótese implantada como critério para avaliar quantitativamente a regeneração alveolar.
Observa-se que o viés observador influencia significativamente a variaçãoLua para parâmetros morfológicos pulmonares ( por exemplo , MIL e ILV). Protocolos padronizados podem ser usados para evitar este viés na determinação de ILV e MLI, que são os dois parâmetros utilizados no cálculo de ISA. Aqui, fornecemos protocolos altamente detalhados e padronizados para medir esses parâmetros pulmonares. Importante, a capacidade de quantificar com precisão a ISA promete melhorar a confiabilidade e a reprodutibilidade dos estudos sobre a função pulmonar em modelos de regeneração alveolar induzida por lesão e deve facilitar descobertas mecanicistas em múltiplas doenças pulmonares.
Protocol
Representative Results
Discussion
Neste protocolo, fornecemos descrições detalhadas sobre a medição de parâmetros pulmonares após PNX do pulmão esquerdo do rato e implantação da prótese. Atualmente, a ISA é considerada uma métrica chave para a avaliação da função respiratória em muitas doenças pulmonares e na regeneração alveolar induzida por lesão. No entanto, embora a comunidade de pesquisa pulmonar esteja de acordo sobre a utilidade da ISA como métrica útil, até o momento, houve pouca consideração da padronização da medida…
Declarações
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer o Instituto Nacional de Ciências Biológicas, Pequim, pela assistência. Este trabalho foi apoiado pela Fundação Municipal de Ciências Naturais de Pequim (nº Z17110200040000).
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referências
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

