En standardisert metode for måling av indre lungeoverflateområde via muspneumonektomi og proteseimplantasjon
Summary
Interne lungeoverflatearealer (ISA) er et kritisk kriterium for å vurdere lungemorfologi og fysiologi i lungesykdommer og skadefremkalt alveolær regenerering. Vi beskriver her en standardisert metode som kan minimere måleforstyrrelsen for ISA i både lunge pneumonectomy og protesimplantasjon musemodeller.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
Lungens grunnleggende funksjon er utveksling av oksygen og karbondioksid mellom blodkar og atmosfære. Lungesykdommer som bronkopulmonal dysplasi (BPD), kronisk obstruktiv lungesykdom (KOL) og akutt respiratorisk infeksjon, resulterer i redusert ISA 2 . Forskere som studerer lungesykdommer, har utviklet flere kvantitative metoder for å evaluere morfologiske endringer i lungene, inkludert MLI, ILV, antall gassutvekslingsenheter, ISA og lungevevinnets samsvar 2 , 3 . Banebrytende studier av Weibel et al. 4 og Duguid et al. 5 sammen etablert at ISA kan brukes som et direkte mål for lungegassutvekslingskapasitet i menneskelige lunger og kan brukes som et kriterium for å bestemme emfysem alvorlighetsgrad. En rekke studier publisert i de siste fem årene har brukt lungemorfologiske parametere ( f.eks. </eM> ISA og MLI) for å vurdere morfologiske og funksjonelle endringer i muskelungen under utvikling 6 og under gjenoppretting fra skade PNX 1 , 7 . ISA beregnes ved bruk av ligning 1 8 , 9 :
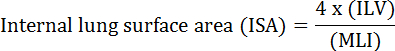
, Hvor ILV er det interne lungevolumet og MLI er en mellomparameter som representerer den lunge perifere luftrommet størrelse 10 .
PNX, den kirurgiske fjerning av en eller flere lungelabber, har blitt rapportert mye for å indusere alveolær regenerering hos mange arter, inkludert mennesker 11 , mus 1 , hunder 12 , rotter 13 og kaniner 14 , 15 . En studY av muslungene ved fjorten dager etter PNX viste at både utvidelsen av eksisterende alveoli og de novo dannelsen av alveoler bidrar til restaurering av ISA, ILV og antall alveoler i de gjenværende lungevevene 1 . Vi og andre har vist at innsetting av materialer som svamp, voks eller en tilpasset protese i det tomme thoracic hule som følger PNX ( dvs. proteseimplantasjon) forringer alveolær regenerering. Det er nå fastslått at mekanisk kraft fungerer som en av de viktigste faktorene for å starte alveolær regenerering 1 , 16 , 17 . Slike studier har fremhevet effekten av å bruke ISA-verdier fra PNX-behandlede og protese-implanterte lunger som et kriterium for kvantitativt å evaluere alveolær regenerering.
Observer bias er kjent for å vesentlig påvirke målt vaLunger for lungemorfologiske parametere ( f.eks . MIL og ILV). Standardiserte protokoller kan brukes til å eliminere denne bias ved å bestemme både ILV og MLI, som er de to parametrene som brukes i beregningen av ISA. Her gir vi svært detaljerte, standardiserte protokoller for måling av disse lungeparametrene. Det er viktig at evnen til nøyaktig kvantifisering av ISA lover å forbedre påliteligheten og reproduserbarheten av studier av lungefunksjon i skadefremkalte alveolære regenereringsmodeller og skal lette mekaniske funn i flere lungesykdommer.
Protocol
Representative Results
Discussion
I denne protokollen gir vi detaljerte beskrivelser av måling av pulmonale parametere etter musen, venstre lungepNX og proteseimplantasjon. ISA anses nå å være en nøkkelstatistikk for vurdering av respiratorisk funksjon i mange lungesykdommer og ved skadefremkalt alveolær regenerering. Imidlertid, selv om lungforskningsfellesskapet er enig om bruken av ISA som en nyttig metrisk, har det hittil vært lite hensyn til standardiseringen av måling av ILV og MLI, de to parametrene som brukes til å beregne ISA. Åpenbar…
Declarações
The authors have nothing to disclose.
Acknowledgements
Forfatterne vil gjerne anerkjenne Nasjonalt institutt for biologiske vitenskap, Beijing for bistanden. Dette arbeidet ble støttet av Beijing Municipal Natural Science Foundation (nr. Z17110200040000).
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
Referências
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

